-
1. Показания к применению
РинФаст® применяется в терапии сахарного
диабета у взрослых, подростков и детей старше 1 года.
-
2. Режим дозирования и путь введения
Доза препарата должна определяться лечащим врачом индивидуально для каждого пациента в зависимости от потребности в инсулине.
РинФаст® при подкожном введении начинает действовать через 10-20 минут, поэтому его можно вводить либо непосредственно перед приемом пищи, либо не более чем за 15 минут до еды. При необходимости РинФаст® можно вводить сразу после приема пищи.
РинФаст® сильнее снижает содержание глюкозы крови в первые 4 часа после приема пищи, чем растворимый человеческий инсулин, поскольку максимальный эффект препарата наблюдается уже через 1-3 часа после инъекции. Кроме того, продолжительность действия препарата РинФаст® короче, чем у генно-инженерного инсулина человека, и составляет от 3 до 5 часов, отличаясь у разных людей или даже у одного и того же человека. Продолжительность действия зависит от места инъекции, степени его кровоснабжения, температуры тела и уровня физической активности человека.
РинФаст® может использоваться в комбинации с другими сахароснижающими препаратами (не относящимися к инсулинам), длительно действующими препаратами инсулина в составе базис-болюсной/базал-болюсной инсулинотерапии или в системах постоянной подкожной инфузии инсулина.
Подкожные инъекции препарата РинФаст®
Подкожное введение препарата проводится в область живота, ягодиц, наружных поверхностей плеча или бедра. Наиболее предпочтительно введение препарата в область передней брюшной стенки ввиду более высокой скорости всасывания. Места инъекций необходимо чередовать таким образом, чтобы одно и то же место не использовалось чаще одного раза в месяц – это позволяет снизить риск развития липодистрофии. После введения препарата не следует массировать место инъекции.
Необходимо строго соблюдать технику введения препарата во избежание попадания лекарственного средства непосредственно в кровеносный сосуд. Для обучения и контроля техники введения следует обратиться к лечащему врачу.
Постоянная подкожная инфузия препарата РинФаст®
РинФаст® может использоваться для постоянных подкожных инсулиновых инфузий (ППИИ) в инсулиновых насосах (помпах) в область передней брюшной стенки. Необходимо периодически менять места введения инсулина с помощью помпы. Перед началом постоянной подкожной инфузии инсулина с помощью инсулиновой помпы необходимо проконсультироваться с лечащим врачом.
Внимательно изучите инструкцию и строго следуйте рекомендациям производителя по эксплуатации инсулиновой помпы. Инфузионный набор следует менять в соответствии с инструкцией производителя данного набора. Неисправность инсулиновой помпы или закупорка инфузионной системы могут привести к быстрому повышению уровня глюкозы в плазме крови. Если у Вас имеется подозрение, что инфузия инсулина прекратилась, следуйте инструкции по использованию Вашей инсулиновой помпы и при необходимости сообщите об этом лечащему врачу.
При использовании препарата РинФаст® в системе постоянной подкожной инфузии инсулина его не следует смешивать с другими препаратами инсулина.
Внутривенная инфузия препарата РинФаст®
При необходимости, внутривенное введение препарата РинФаст® может осуществляться только медицинским персоналом в условиях адекватного мониторинга уровня глюкозы и ионов калия в плазме крови.
-
3. Доступные лекарственные формы
Раствор для внутривенного и подкожного
введения.
-
4. Противопоказания
Гиперчувствительность к инсулину аспарт или любым вспомогательным веществам в его составе (вспомогательные вещества указаны в разделе 9).
Гипогликемия (препарат нельзя вводить во время эпизодов гипогликемии).
-
5. Нежелательные реакции
Нежелательные реакции, которые могут возникнуть при использовании инсулина РинФаст®, не отличаются от таковых при использовании любого другого препарата инсулина и обусловлены действием инсулина и белковой природой молекулы.
5.1. Гипогликемия
Эпизоды гипогликемии чаще других нежелательных реакций встречаются у пациентов, получающих терапию препаратами инсулина. Она может развиться, если доза инсулина слишком высока по отношению к потребности в инсулине. Тяжелая гипогликемия может привести к потере сознания, а в некоторых случаях к смерти пациента. На вероятность возникновения гипогликемий влияют различные факторы, включая дозу инсулина, режим питания и диету, а также уровень физической активности. В исследованиях инсулина аспарт не было выявлено различий в частоте эпизодов гипогликемии по сравнению с препаратами человеческого инсулина.
5.2. Местные аллергические реакции
У части пациентов встречаются местные аллергические реакции (≥1/100, но <1/10), которые проявляются покраснением, отеком и зудом в месте введения препарата. Как правило, они развиваются в течение нескольких дней или даже недель. Эти реакции обычно временные и проходят по мере продолжения лечения. В ряде случаев возникновение таких реакций связано с неправильной техникой введения и средствами личной гигиены.
5.3. Системные аллергические реакции
В редких случаях при введении инсулина может
развиться системная аллергическая реакция (≥1/10 000, но <1/1 000). Системные
аллергические реакции проявляются высыпаниями по всему телу, зудом кожи, одышкой,
снижением артериального давления, повышенной частотой сердечных сокращений и
потоотделением. При развитии такой реакции пациенту следует незамедлительно
обратиться к врачу, вызвав скорую медицинскую помощь.
5.4. Липодистрофия
Относительно редко (≥1/1 000, но <1/100) в
местах инъекций возникают липодистрофии – изменения (например, уплотнения) в
подкожной жировой клетчатке, которые можно определить на ощупь. Для
предотвращения развития липодистрофий необходимо регулярно менять места
инъекций в пределах одной области и соблюдать технику инъекций.
5.5. Отеки
При терапии инсулином иногда возникают отеки.
Вероятность их возникновения повышается, если пациенты с плохим гликемическим
контролем начинают интенсивную инсулинотерапию. Отеки проходят самостоятельно
при нормализации гликемического контроля. У некоторых пациентов при
одновременном применении препаратов инсулина с тиазолидиндионами (пиоглитазон,
росиглитазон), особенно при наличии сопутствующих заболеваний
сердечно-сосудистой системы, могут возникнуть или усугубиться симптомы сердечной
недостаточности (одышка, отеки лодыжек и голени, быстрый набор веса). При возникновении
или развитии симптомов сердечной недостаточности при одновременном применении
препарата РинФаст® и тиазолидиндионов необходимо обраться к лечащему врачу.
5.6. Безопасность препарата РинФаст® в клинических исследованиях (данные испытаний, проведенных ГЕРОФАРМ)
Для биологических препаратов ключевым параметром безопасности считается их иммуногенность. Иммуногенность – потенциальная способность препарата вызывать иммунный ответ со стороны организма человека. При возникновении иммунного ответа происходит образование антител к инсулину, которые могут связываться с самим препаратом, вызывая изменения структуры молекулы. В результате, изменяются свойства препарата, его распределение в организме и, как следствие, снижается эффективность лечения.
Исследования безопасности в рамках изучения иммуногенности препарата проводятся для того, чтобы показать, что количество антител, вырабатываемых в ответ на введение инсулина, не способно снизить его терапевтический эффект. А при исследовании биосимилярного инсулина важно также продемонстрировать, что количество антител, которые вырабатываются при введении биосимиляра, не отличаются от уровня таковых при введении референтного (оригинального) препарата. Как правило, иммуногенность аналогов инсулина и генно-инженерного инсулина не оказывает влияния на безопасность или эффективность применения препаратов инсулина. Тем не менее, иммуногенность препарата РинФаст® была изучена в ходе сравнительного клинического исследования.
Наряду с исследованием иммуногенности, безопасность препарата РинФаст® была исследована в отношении частоты возникновения нежелательных явлений. Нежелательные явления – это неблагоприятные с медицинской точки зрения события, возникновение которых имеет потенциальную связь с исследуемым препаратом. В исследовании препарата РинФаст® нежелательное явление представляло собой любой симптом, жалобу или заболевание, время возникновения которого не исключало связи с применением исследуемого препарата. Также в ходе оценки безопасности особый интерес представляли нежелательные явления, возникновение которых характерно для инсулинотерапии (нежелательные явления особого интереса): эпизоды гипогликемий, случаи диабетического кетоацидоза, частота возникновения местных реакций в месте инъекций и аллергические реакции.
Клиническое исследование было проведено с участием пациентов с сахарным диабетом 1 типа. Отбор в исследование (скрининг) прошли 309 участников мужского и женского пола, из которых было включено в исследование (рандомизировано) 264 пациента. В среднем, длительность течения заболевания у субъектов исследования составила 13,5 лет. Средний возраст – 38 лет. Среди участников 51% были женщинами, 49% – мужчинами, а средний ИМТ составил 25 кг/м2. Средний уровень HbA1c до начала лечения –8,7%. Длительность терапии препаратом РинФаст® составила 30 недель, 4 недели из которых занял период титрации (подбора доз).
Иммуногенность препарата РинФаст®
Уровень анти-инсулиновых антител в клиническом исследовании считался значимым, если у пациентов с исходной концентрацией антител к инсулину менее 10 Ед/мл, их концентрация в крови в результате лечения повышается до 10 и более Ед/мл, а у пациентов, имеющих с концентрацией АТ более 10 Ед/мл на этапе отбора, происходит повышение концентрации антител на 30 % и более от исходного уровня.
В 30-недельном клиническом исследовании препарата РинФаст® значимый уровень анти-инсулиновых антител был зарегистрирован у 9,1% участников (у 12 из 132 участников). Динамика концентрации антител носила разнонаправленный характер: в период с 12 по 16 неделю терапии стабильными дозами препарата РинФаст® у некоторых пациентов наблюдалось снижение концентрации антител до значений, соответствующих отсутствию иммунного ответа. У других участников иммунный ответ развивался только после 12 недели лечения. Тем не менее, у большинства пациентов изменение концентрации антител происходило в диапазоне, не превышающем порог иммунного ответа, то есть не имело существенных отличий от исходных значений – до начала лечения.
Нежелательные явления препарата РинФаст®
В Таблице 1 представлены данные по нежелательным реакциям, зарегистрированным в клиническом исследовании в группе, получающей терапию препаратом РинФаст® в течение 30 недель.

В данном исследовании нежелательные явления были зафиксированы у 38 пациентов, получавших РинФаст®. Однако, большинство нежелательных явлений (у 36 пациентов) не были связаны с лечением препаратом РинФаст®.
К самым частым нежелательным явлениям, которые представляют особый интерес в исследованиях безопасности препаратов инсулина, является количество гипогликемических эпизодов. Регистрация эпизодов гипогликемий производилась по данным самоконтроля гликемии пациентом (глюкометром) или по данным оценки в центральной лаборатории (анализ плазмы крови). Все пациенты выполняли самоконтроль гликемии с помощью портативного глюкометра на протяжении всего исследования, кроме того, три раза в течение исследования пациенты выполняли 7-ми точечный тест гликемии, а на 12 и 26 неделях лечения стабильными дозами оценка уровня глюкозы в плазме крови выполнялась в центральной лаборатории.
Результаты по зарегистрированным эпизодам гипогликемий представлены в Таблице 2.
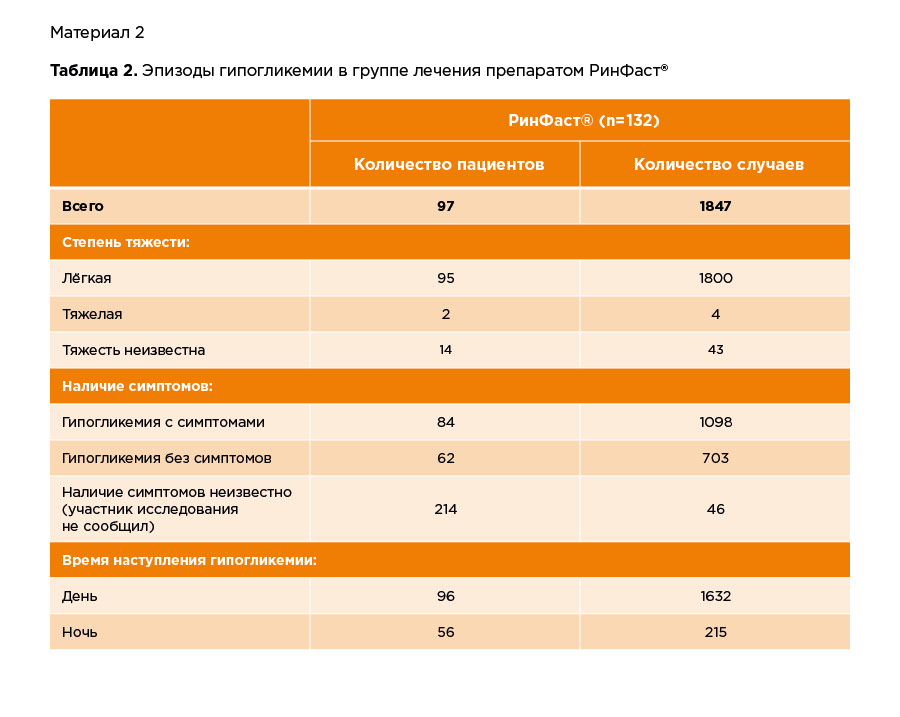
У 73% пациентов за весь период исследования был зарегистрирован, как минимум, 1 эпизод гипогликемии. Но несмотря на это, большая часть эпизодов гипогликемии была легкой степени, которая корректировалась самим пациентом (например, приемом сахаросодержащих продуктов).
За время исследования только у 1 пациента была зарегистрирована реакция в месте введения препарата РинФаст®.
-
6. Взаимодействие с другими лекарственными препаратами
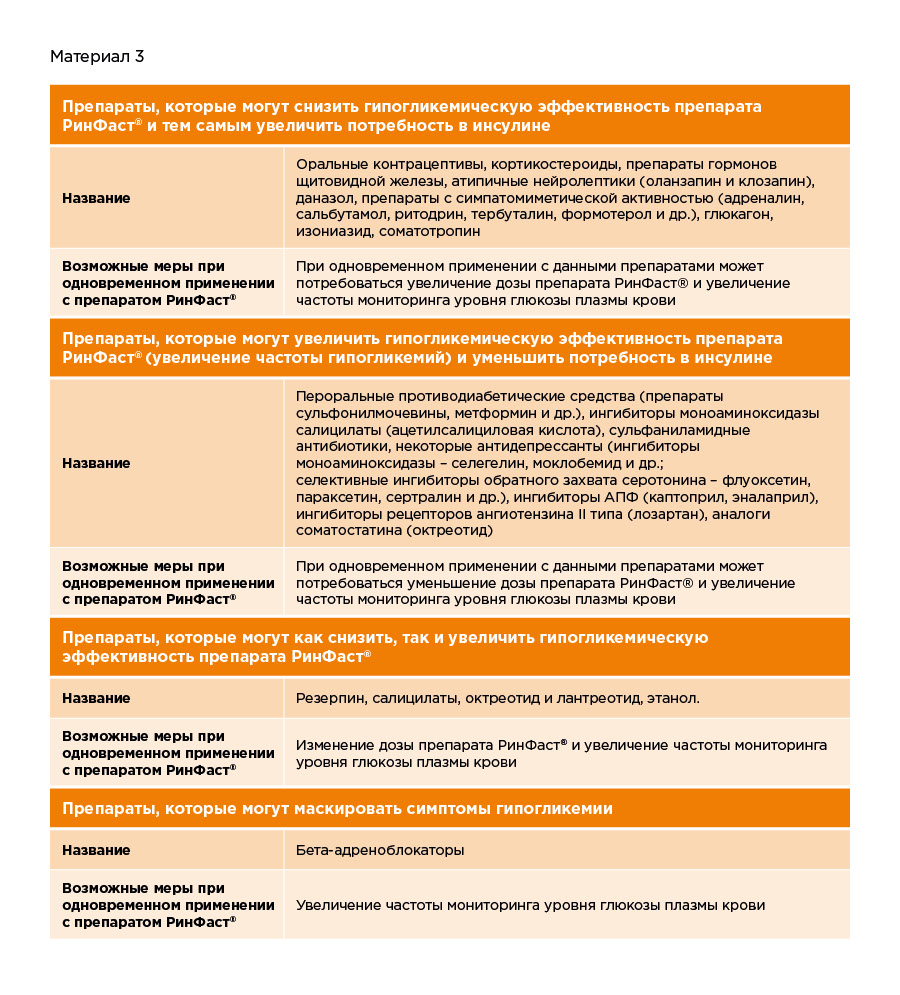
При одновременном применении некоторые лекарственные препараты могут тем или иным образом изменять действие друг друга. Именно поэтому перед началом лечения особенно важно сообщить врачу о всех других принимаемых лекарственных средствах, включая фитодобавки и любые биологические активные вещества.
Ниже приведен перечень препаратов, которые могут влиять на действие препаратов инсулина и возможные меры по минимизации последствий этого взаимодействия.
-
7. Особые популяции пациентов
Особые популяции – это группы пациентов, которые отличаются от основной популяции функциональным состоянием организма. В силу особенностей протекания различных процессов, такие пациенты рассматриваются отдельно от основной популяции. Поэтому для них характерна иная скорость всасывания, распределения, превращения и выведения препарата из организма. Так, например, у пациентов с заболеваниями печени может быть замедлено превращение препарата в активную форму, что приведет к снижению эффективности лечения. Таким образом, пациентам особой популяции для достижения терапевтического эффекта может потребоваться иная доза препарата, которая подбирается в ходе дополнительных исследований особых групп пациентов.
Изучение действия биоаналогичного препарата РинФаст® в особых популяциях было проведено в клинических исследованиях референтного препарата инсулин аспарт, 100 Eд/мл. В соответствии с Решением ЕЭК №89 от 03.11.2019 г. и директивой Европейского Медицинского Агентства 2015 (EMEA/CHMP/BMWP/32775/2005_Rev. 1) биосимиляр может применяться во всех популяциях, зарегистрированных для референтного препарата.
Ниже приведены данные исследований референтного препарата Новорапид® на особых популяциях пациентов, которые были экстраполированы* на РинФаст® на основании доказанной высокой степени сходства молекулы, готовой лекарственной формы, эффективности и безопасности препарата.
Беременные женщины
Согласно результатам многочисленных исследований, к настоящему времени были накоплены достаточные сведения о безопасности применения инсулина аспарт у беременных женщин. Данные двух рандомизированных контролируемых клинических исследований (одна группа пациентов получала инсулин аспарт, другая – человеческий инсулин; в обеих группах пациенты были распределены случайным образом) не было выявлено какого-либо неблагоприятного действия инсулина аспарт на течение беременности или здоровье новорожденного, по сравнению с человеческим инсулином.
Особенно важно на протяжении всего периода беременности тщательно следить за уровнем глюкозы крови, поскольку плохой контроль гликемии может оказывать негативное влияние как на течение беременности, так и на здоровье и развитие будущего ребенка. Таким образом, препарат РинФаст® может назначаться при беременности.
Потребность в инсулине, как правило, изменяется в течение беременности: снижается в I триместре (до 13-й недели беременности) и постепенно повышается во II и III триместрах (с 14 по 27 неделю и с 28 недели до рождения ребенка, соответственно). Но вскоре после родов потребность в инсулине быстро возвращается к тому уровню, который был до беременности. Поэтому о наступлении беременности или ее планировании необходимо сообщить лечащему врачу – он поможет подобрать корректную дозу инсулина.
Кормящие женщины
Вероятно, что инсулин аспарт, как и генно-инженерный инсулин человека, попадает в грудное молоко. Препарат инсулин аспарт является полипептидом и должен разрушаться в кишечнике ребенка, поэтому препарат инсулин аспарт может применяться в период кормления грудью, и не должен оказывать неблагоприятное воздействие на состояние здоровья ребенка, находящегося на грудном вскармливании.
Применение препарата инсулин аспарт при кормлении грудью может потребовать дополнительного подбора дозы препарата и диеты.
Дети
Как и для взрослых, доза препарата инсулин аспарт для детей подбирается индивидуально в зависимости от метаболических потребностей. Исследования по применению референтного препарата инсулин аспарт проводились у детей в возрасте 6-12 лет и подростков в возрасте 13-17 лет с сахарным диабетом 1 типа.
Было показано, что инсулин аспарт быстро всасывается в обеих возрастных группах. Время достижения максимальной концентрации препарата у детей в обеих возрастных группах соответствует таковому у взрослых. Однако в обеих группах наблюдались некоторые различия в максимальной концентрации инсулина аспарт в крови. Эти различия особенно подчеркивают важность индивидуального подбора дозы препарата среди детей всех возрастов с сахарным диабетом 1 типа.
Пожилые пациенты
РинФаст® может использоваться в рамках терапии сахарного диабета у пациентов возрасте 65 лет и старше. В клиническом исследовании с участием пожилых пациентов (65-83 лет) с сахарным диабетом 2 типа разница фармакокинетики (процессов всасывания, распределения, превращения, выведения препарата) между инсулином аспарт и растворимым человеческим инсулином была такой же, как у более молодых пациентов с сахарным диабетом и здоровых добровольцев. У пожилых пациентов наблюдалось уменьшение скорости всасывания. Поэтому максимальный эффект препарата наступал несколько позже – через 60-120 минут после введения препарата, а максимальная концентрация инсулина аспарт в крови была такой же, как у более молодых пациентов с сахарным диабетом 2 типа и немного меньше, чем у больных сахарным диабетом 1 типа.
Пациенты с нарушенной функцией почек
У пациентов с нарушенной функцией почек замедляется выведение лекарственного препарата из организма. В связи с этим, при лечении препаратом аспарт может быть повышен риск развития гипогликемий. Часто у пациентов с заболеваниями почек требуется снижение дозы препаратов инсулина.
Исследование фармакокинетики инсулина аспарт было проведено у 18 пациентов, функция почек которых колебалась от нормальной до тяжелой формы нарушения. Не было обнаружено явного влияния степени нарушения функции на максимальную концентрацию и время достижения максимальной концентрации. Данные были получены для лиц с нарушениями функции почек средней и тяжелой формы, но не распространялись на пациентов с почечной недостаточностью, которым требовался диализ.
Пациенты с нарушенной функцией печени
Исследование фармакокинетики инсулина аспарт было проведено при введении препарата 24 пациентам, функция печени которых находится в диапазоне от нормальной до тяжелой формы нарушения. У лиц с нарушением функции печени скорость всасывания инсулина аспарт была снижена и более непостоянна. В результате этого, время достижения максимальной концентрации препарата в плазме крови увеличилось с 50 минут (у лиц с нормальной функцией печени) до 85 минут (у лиц с нарушением функции печени средней и тяжелой степени тяжести).
Кроме того, в связи с пониженной способностью к глюконеогенезу и замедлением расщепления инсулина у пациентов с печеночной недостаточностью, потребность в инсулине может снижаться; однако, у пациентов с хронической печеночной недостаточностью повышенная инсулинорезистентность может привести к увеличению потребности в инсулине.
_______________
*Экстраполяция — это устоявшийся научный принцип, который применяется в фармацевтике и предполагает перенос результатов исследований на другие показания применения препарата или группы пациентов на основании проведенных исследований сопоставимости.
-
8. Передозировка
Для препаратов инсулина строго не определена доза, которая может быть использована для регистрации передозировки. Передозировку следует рассматривать как избыточное введение препарата инсулина относительно количества потребленной пищи и расхода энергии.
Последствием избыточного введения препарата может быть развитие гипогликемии и гипокалиемии. Легкие эпизоды гипогликемии могут быть купированы пероральным приемом глюкозы или пищи с высоким содержанием глюкозы. Передозировка (превышение количества введенного инсулина над потребностью в инсулине) может потребовать коррекции дозы, режима питания или физической активности. Более тяжелые эпизоды гипогликемии, сопровождающиеся потерей сознания и неврологическими нарушениями, могут потребовать внутримышечного/подкожного введения глюкагона или внутривенного введения концентрированного раствора глюкозы. Может потребоваться длительное потребление углеводов и наблюдение, потому что гипогликемия может развиться вновь после купирования. Коррекция гипокалиемии проводится только квалифицированным медицинским персоналом с помощью введения препаратов, содержащих калий.
-
9. Описание
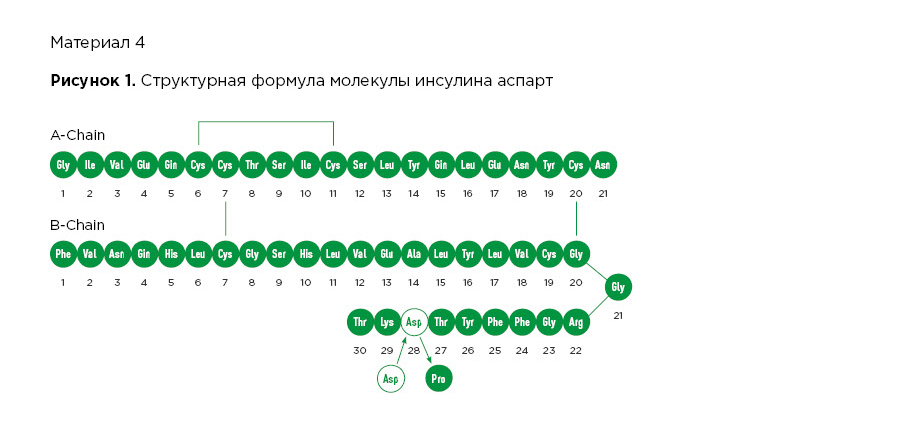
РинФаст® (инсулин аспарт) – это аналог инсулина человека ультракороткого действия. РинФаст® получают путем биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae. РинФаст® состоит из двух аминокислотных цепей: A и B. Цепь А состоит из 21 аминокислоты, внутри цепи имеется одна дисульфидная связь, цепь B состоит из 30 аминокислот. Цепи А и B связаны между собой двумя дисульфидными связями. Инсулин аспарт отличается от растворимого человеческого инсулина тем, что аминокислота пролин (Pro) в положении В28 замещена на аспарагиновую кислоту (Asp, показана на Рисунке 1 белым цветом). Аспарагиновая кислота заряжена отрицательно, вследствие чего снижается тенденция молекул инсулина к формированию комплексов из нескольких молекул (гексамеров), и инсулин аспарт всасывается быстрее, чем растворимый человеческий инсулин. Эмпирическая формула препарата РинФаст® имеет следующий вид: C256H381N65O79S6. Молекулярная масса составляет 5825,8 Да. Структурная формула препарата РинФаст® представлена на Рисунке 1.
 РинФаст® – стерильный, прозрачный и бесцветный раствор. В 1 мл препарата содержится инсулин аспарт – 100 Ед; вспомогательные вещества: глицерол – 16,0 мг, фенол – 1,5 мг, метакрезол – 1,72 мг, цинк – 19,6 мкг, натрия хлорид - 0,58 мг, натрия гидрофосфат дигидрат – 1,25 мг, натрия гидроксид 2М - около 2,2 мг, натрия гидрофосфат дигидрат – 1,25 мг, хлористоводородная кислота 2М - около 1,7 мг, вода для инъекций – до 1 мл.
РинФаст® – стерильный, прозрачный и бесцветный раствор. В 1 мл препарата содержится инсулин аспарт – 100 Ед; вспомогательные вещества: глицерол – 16,0 мг, фенол – 1,5 мг, метакрезол – 1,72 мг, цинк – 19,6 мкг, натрия хлорид - 0,58 мг, натрия гидрофосфат дигидрат – 1,25 мг, натрия гидроксид 2М - около 2,2 мг, натрия гидрофосфат дигидрат – 1,25 мг, хлористоводородная кислота 2М - около 1,7 мг, вода для инъекций – до 1 мл.
-
10. Клиническая фармакология
Инсулин действует через специфические рецепторы, расположенные на поверхности мембраны клеток органов-мишеней и образует инсулин-рецепторный комплекс, который стимулирует внутриклеточные процессы. Под действием инсулина в крови снижается уровень глюкозы, поскольку усиливается ее захват тканями и увеличивается транспорт внутрь клеток. К органам-мишеням инсулина относятся печень, скелетная мышечная и жировая ткани.
В печени инсулин стимулирует синтез гликогена. Инсулин также способствует синтезу жирных кислот в печени, которые секретируются в кровь в виде липопротеинов. В скелетных мышцах инсулин увеличивает синтез белка и гликогена. В жировой ткани инсулин стимулирует превращение липопротеинов в жирные кислоты и триглицериды. Кроме того, инсулин препятствует разрушению триглицеридов в жировой ткани. Инсулин стимулирует поглощение клетками аминокислот и некоторых ионов, например, ионов калия, магния и фосфатов.
Фармакокинетика и фармакодинамика препарата РинФаст® были изучены в ходе перекрестного эугликемического клэмп-исследования, проведенного ГЕРОФАРМ (см. пункт 10.1 и 10.2).
10.1. Фармакодинамика
Фармакодинамический профиль препарата РинФаст® определен в ходе перекрестного эугликемического клэмп-исследования с участием 26 здоровых добровольцев, которые были разделены на две группы в соотношении 1:1. Исследование проходило в 2 этапа. На первом этапе 1 группа получала препарата РинФаст® (биоаналогичный инсулин аспарт), тогда как 2 группа в это же время получала референтный препарат – НовоРапид® Пенфилл® (оригинальный инсулин аспарт). Во втором периоде клэмпа происходил "перекрест", и каждая группа получала препарат, противоположный первому этапу. Исследуемые препараты вводили подкожно, в дозе 0,3 ЕД/кг. Время до максимального эффекта препарата (tGIRmax) составило 2,75 ч. Средняя площадь под кривой скорости инфузии глюкозы (AUCGIR0-t) составила 43,48 мг/(кг x 60). Средняя максимальная скорость инфузии глюкозы (GIRmax) составила 12,6 мг/кг. Средняя площадь под кривой скорости инфузии глюкозы в течение первого часа (AUCGIR0-1) составила 2,47 мг/(кг х 60), в течение первых трех часов (AUCGIR0-3) – 19,74 мг/(кг х 60), в течение первых пяти часов (AUCGIR0-5) – 35,86 мг/(кг х 60).
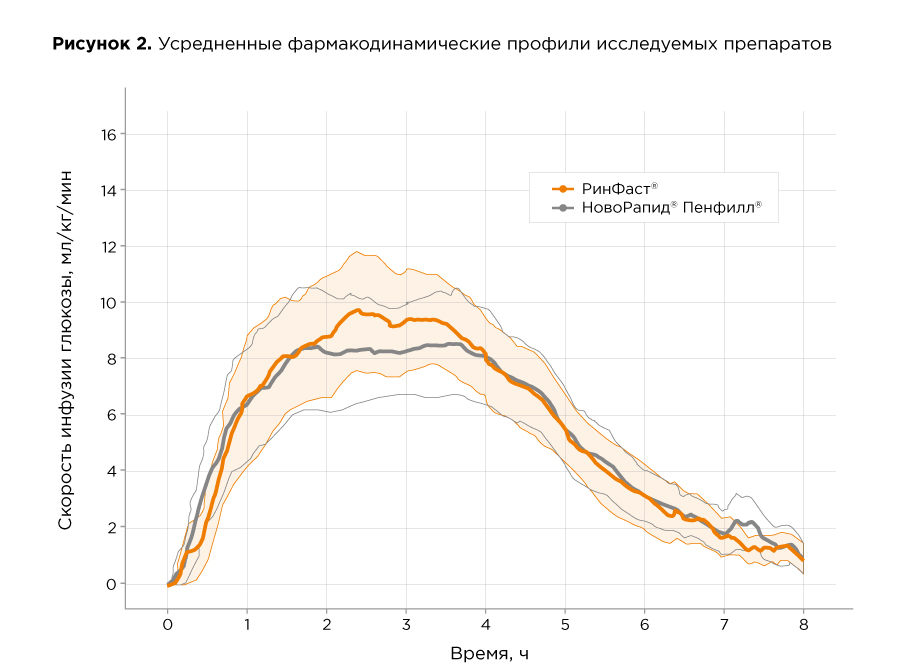
В результате исследования было показано, что оцениваемые параметры фармакодинамики препарата РинФаст® и референтного препарата Новорапид® сопоставимы.
10.2. Фармакокинетика
Фармакокинетический профиль препарата РинФаст® определен в ходе перекрестного эугликемического клэмп-исследования с участием 26 здоровых добровольцев при однократном подкожном введении препарата в дозе 0,3 ЕД/кг. Время достижения максимальной концентрации препарата (tmax) после подкожного введения составило 1,51 ч. Максимальная концентрация инсулина составила 286,95 мкЕД/мл. Площадь под кривой концентрации инсулина (AUCins.0-8) составила 776,9 мкЕД/мл х ч.
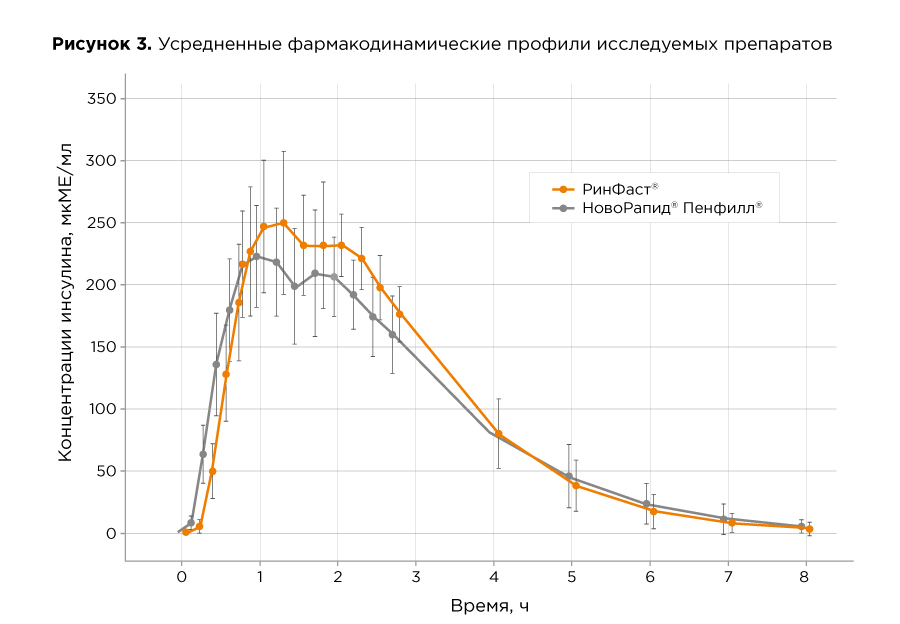
В результате исследования было показано, что оцениваемые параметры фармакодинамики препарата РинФаст® и референтного препарата инсулин аспарт (НовоРапид®) сопоставимы.
-
11. Клинические исследования
Данные исследований референтного препарата НовоРапид®, результаты актуальны для препарата РинФаст® на основании научного принципа экстраполяции*
Инсулин аспарт обеспечивает лучший контроль гликемии в течение 4 часов после приема пищи в сравнении с человеческим инсулином короткого действия. Уровень постпрандиальной гликемии (после еды) на 22–38% ниже у пациентов, получающих инсулин аспарт, чем человеческий инсулин короткого действия. Немаловажным является также снижение риска гипогликемических эпизодов, в особенности, частоты ночных гипогликемий. Данный результат был получен в двойном слепом перекрестном сравнительном исследовании человеческого инсулина короткого действия и препарата инсулин аспарт.
В 2008 г. Европейское агентство по лекарственным средствам одобрило применение инсулина аспарт для внутривенного введения при лечении кетоацидоза. Есть указание на применение инсулина аспарт для внутривенного введения и в российской инструкции по применению препарата.
Исследования показали, что инсулин аспарт более совместим с инсулиновыми помпами, чем другие аналоги инсулина ультракороткого действия (инсулины лизпро и глулизин). В многочисленных сравнительных исследованиях инсулин аспарт (НовоРапид®) в режиме продолжительной подкожной инфузии инсулина продемонстрировал более высокую скорость всасывания, более высокий процент достижения пациентами возрастных целевых значений HbА1с, лучшую стабильность постпрандиального гликемического контроля и меньший риск развития гипогликемии, в том числе ночных эпизодов гипогликемии.
ГЕРОФАРМ проводил исследования безопасности и эффективности препарата РинФаст® в сравнении с референтным препаратом, чтобы доказать сопоставимость профилей препаратов. Подробное описание таких исследований приведено ниже.
Исследование препарата РинФаст®
Многоцентровое рандомизированное клиническое исследование иммуногенности, эффективности и безопасности препарата РинФаст® выполнено с участием 264 пациентов с сахарным диабетом 1 типа. В среднем, длительность течения заболевания у участников исследования составила 13,5 лет. Средний возраст участников составил 38 лет. Среди участников исследования 51% были женщинами, 49% – мужчинами, а средний ИМТ составил 25 кг/м2. Средний уровень HbA1c до начала лечения – 8,7%. Длительность терапии препаратом РинФаст® составила 30 недель, 4 из которых занял период титрации (подбора доз).
В таблице и на рисунках ниже приведены данные по динамике гликированного гемоглобина и уровня глюкозы плазмы крови натощак. Различий между препаратами РинФаст® и НовоРапид® по этим показателям выявлено не было.
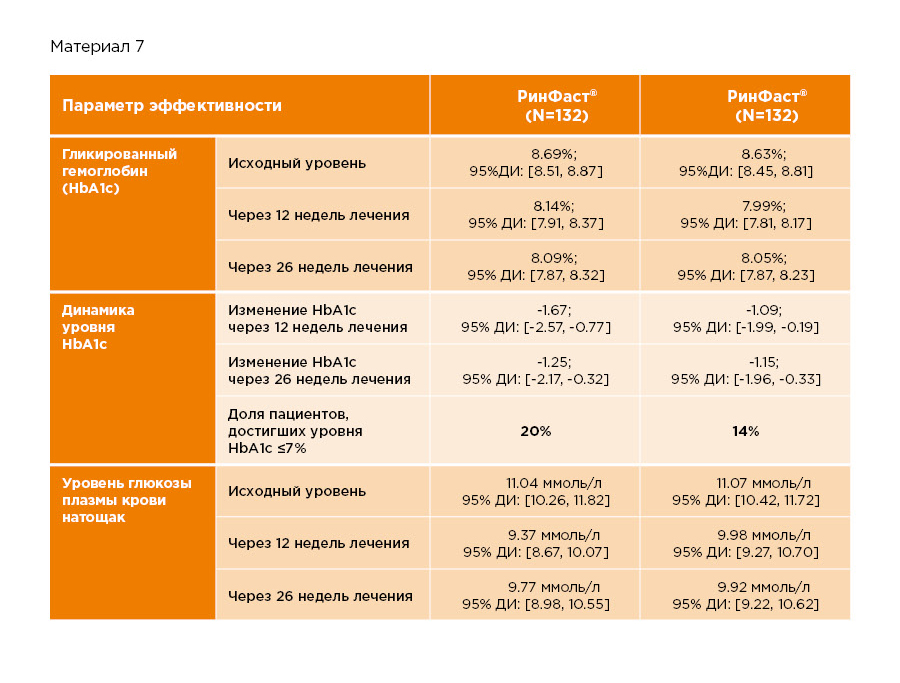
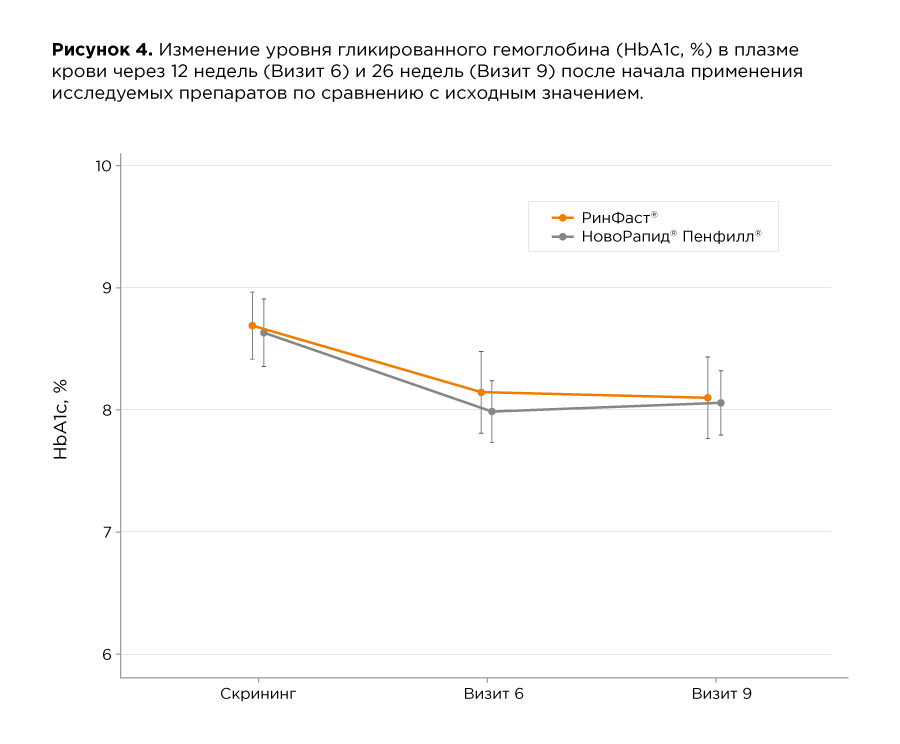
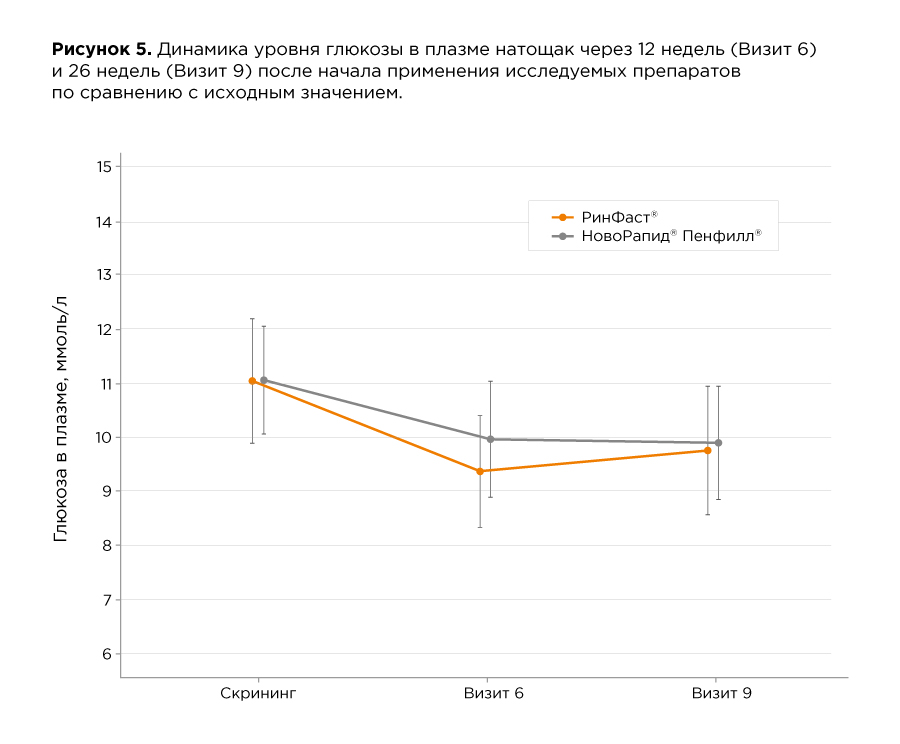
Исследование инсулина аспарт при сахарном диабете 2 типа (данные исследований референтного препарата НовоРапид®, результаты актуальны для препарата РинФаст® на основании научного принципа экстраполяции*)
3-летнее исследование «4Т» было посвящено изучению различных видов старта инсулинотерапии при неэффективности таблетированных препаратов при сахарном диабете 2 типа: назначение базального или двухфазного инсулиновых аналогов или прандиальной регуляцией гликемии с использованием инсулина аспарт. Все три варианта старта инсулинотерапии эффективны с точки зрения снижения уровня гликированного гемоглобина. Однако в группе пациентов, применявших трехинъекционный прандиальный режим терапии препаратом аспарт, снижение уровня НbА1с было наиболее значимым и достигло 1,4%. Необходимо также отметить, что именно в данной группе у наибольшего числа пациентов удалось достичь целевого параметра НbА1с ниже 7%. Единственным недостатком данного варианта старта инсулинотерапии было несколько большее увеличение массы тела в сравнении с традиционными подходами, что ограничивает данный старт инсулинотерапии у пациентов с выраженной избыточной массой тела. Через год от начала исследования при добавлении базального инсулинового аналога в качестве интенсификации инсулинотерапии было получено дополнительное снижение HbA1c на 0,4%. Число больных, достигших целевого уровня HbA1c менее 7%, было больше, чем в двух других группах, при минимальном числе гипогликемий.
Было показано, что добавление к базальному инсулину ультракороткого инсулина аспарт позволяет улучшить контроль гликемии, дополнительно снижая уровень HbA1c на 0,5 – 1,2%, и позволяет достичь компенсации углеводного обмена (HbA1c ≤ 7%) более чем у 60% пациентов.
В исследовании «4Т» был отмечен минимальный риск тяжелых и легких гипогликемий. Этот показатель составил 1,7 эпизода/пациента в год. В ряде европейских стран, а также в США проведен фармакоэкономический анализ эффективности инсулина аспарт в базисно-болюсном режиме на основании данных исследования PREDICTIVETM. Анализ показал увеличение ожидаемой продолжительности качественной жизни и уменьшение случаев осложнений сахарного диабета при использовании инсулина аспарт в сравнении с человеческим инсулином. Как следствие – снижаются затраты на лечение пациентов.
Было проведено 16-недельное клиническое исследование, в котором сравнивалось содержание глюкозы в крови после еды на фоне введения инсулина аспарт (до еды), человеческого инсулина/двухфазного человеческого инсулина 30 (до еды) и изофан-инсулина (вводимого перед сном). В исследовании участвовало 167 больных от 10 до 18 лет. Средние значения НbА1с в обеих группах оставались близкими к начальным значениям на протяжении всего исследования. Также при применении инсулина аспарт или двухфазного человеческого инсулина 30 не наблюдалось различий в частоте возникновения гипогликемии.
Клиническое исследование инсулина аспарт у детей и подростков (данные исследований референтного препарата Новорапид® в сравнении с генно-инженерным инсулином человека короткого действия, результаты актуальны для препарата РинФаст® на основании научного принципа экстраполяции*)
Инсулиновые аналоги короткого действия, воссоздавая физиологический профиль инсулинемии, позволяют получить целый ряд преимуществ в терапии сахарного диабета 1 типа у детей и подростков. Например, это возможность инъекции инсулина после приема пищи.
В многоцентровом открытом перекрестном 12-недельном исследовании, в котором участвовало 26 детей в возрасте от 2,3 до 6,9 лет, сравнивалась эффективность и безопасность препрандиального введения (перед приемом пищи) человеческого инсулина короткого действия и постпрандиального введения (после приема пищи) препарата инсулин аспарт. Гликемический контроль был аналогичен в обеих группах, не выявлено различий в общей частоте гипогликемий и в частоте тяжелых гипогликемических эпизодов. Вместе с этим большинство родителей отметили удобство и отдали предпочтение терапии инсулином аспарт, а также высказали желание продолжить им терапию в дальнейшем.
С марта 2005 г. препарат инсулин аспарт разрешен к применению у детей в возрасте с 2 лет. При решении вопроса о пре- или постпрандиальном введении инсулиновых аналогов короткого действия можно учитывать пищевые привычки пациентов, прием пищи в общественных местах или дома, предпочтения пациентов. В ходе открытого перекрестного 6-недельного исследования у 76 детей (в возрасте от 6 до 17 лет) в 9 европейских центрах гликемический контроль при постпрандиальном введении инсулина аспарт был аналогичным таковому при препрандиальных инъекциях. Не было выявлено различий в общей частоте гипогликемий и в частоте тяжелых гипогликемических эпизодов.
Элизабет Дойл (Elizabeth A. Doyle) и соавт. из Йельского университета докладывали о своем клиническом опыте использования инсулина аспарт в режиме непрерывной подкожной инфузии инсулина с использованием помпы по сравнению с применением инсулинов аспарт и гларгин в режиме многократных инъекций у детей и подростков с СД 1 типа. Было отмечено статистически более значимое снижение уровня HbA1c с 8,2% до 7,3% в процессе проведения терапии в группе помповой терапии по сравнению с режимом многократных инъекций.
Клинические исследования инсулина аспарт у пожилых пациентов (данные исследования референтного препарата НовоРапид® в сравнении с генно-инженерным инсулином человека короткого действия, результаты актуальны для препарата РинФаст® на основании научного принципа экстраполяции*)
При проведении двойного слепого плацебо контролируемого перекрестного исследования с участием 19 пациентов с сахарным диабетом 2 типа в возрасте 70 лет методом эугликемического клэмпа с препаратом инсулин аспарт и человеческим инсулином короткого действия в дозе 0,3 ЕД/кг были показаны фармакокинетические и фармакодинамические преимущества инсулина аспарт. Данное исследование подтвердило более быстрое начало и меньшую продолжительность действия инсулина аспарт в сравнении с человеческим инсулином короткого действия у пожилых пациентов. Полученные результаты подтверждают возможность введения инсулина аспарт непосредственно после еды у пожилых пациентов. Основываясь на результатах клинических исследований, подтверждающих высокую эффективность и безопасность инсулина аспарт у пожилых людей, в 2007 г. препарат был одобрен в Европе для лечения этой категории больных с сахарным диабетом 2 типа.
_______________
*Экстраполяция — это устоявшийся научный принцип, который применяется в фармацевтике и предполагает перенос результатов исследований на другие показания применения препарата или группы пациентов на основании проведенных исследований сопоставимости.
-
12. Условия хранения
Препарат до начала использования следует хранить в холодильнике при температуре от 2 °C до 8 °C, препарат после начала использования следует хранить при комнатной температуре (не выше 30 °C) в защищенном от света или перегревания месте.
Не замораживайте препарат РинФаст® и не используйте ранее замороженный препарат.
Не используйте препарат РинФаст®, если раствор мутный, густой, имеет окрашивание или содержит твердые частицы.
Шприц-ручку не следует хранить с прикрепленной иглой.

-
13. Информация для консультации пациентов
Не следует передавать шприц-ручку для использования другим людям.
Следует сообщить пациенту, что совместное использование шприц-ручки даже при смене иглы может привести к передаче различных инфекционных заболеваний.
Гипергликемия и гипогликемия
Пациента следует уведомить о том, что гипогликемия является наиболее частой нежелательной реакцией при использовании инсулина. Следует сообщить пациенту, как проявляются симптомы гипогликемии. Следует объяснить пациенту, что при возникновении гипогликемии может снижаться способность к концентрации внимания и скорость реакции, это может быть опасно при вождении автомобиля или работе со сложными механизмами.
Также пациенту следует сообщить, что изменение режима инсулинотерапии может приводить к гипер- или гипогликемиям, изменение режима инсулинотерапии следует выполнять под контролем лечащего врача.
Ошибочное введение
Следует рассказать пациенту о необходимости проверки названия препарата перед каждым его использованием.
Введение
РинФаст® следует вводить только в том случае, если раствор выглядит как вода (прозрачный, бесцветный). Следует проверять препарат перед каждым введением.
Действия пациента в особых ситуациях
Пациенты должны быть обучены методам самостоятельного мониторинга глюкозы, технике инъекций инсулина, способам купирования гипогликемий и гипергликемий. Пациенты должны знать о мерах, которые им следует предпринять в случаях развития сопутствующий заболеваний или стресса, пропуска инъекции или введения неадекватной дозы, пропуска приема пищи или неадекватного приема пищи.
-
14. Информация для пациентов






 РинФаст® – стерильный, прозрачный и бесцветный раствор. В 1 мл препарата содержится инсулин аспарт – 100 Ед; вспомогательные вещества: глицерол – 16,0 мг, фенол – 1,5 мг, метакрезол – 1,72 мг, цинк – 19,6 мкг, натрия хлорид - 0,58 мг, натрия гидрофосфат дигидрат – 1,25 мг, натрия гидроксид 2М - около 2,2 мг, натрия гидрофосфат дигидрат – 1,25 мг, хлористоводородная кислота 2М - около 1,7 мг, вода для инъекций – до 1 мл.
РинФаст® – стерильный, прозрачный и бесцветный раствор. В 1 мл препарата содержится инсулин аспарт – 100 Ед; вспомогательные вещества: глицерол – 16,0 мг, фенол – 1,5 мг, метакрезол – 1,72 мг, цинк – 19,6 мкг, натрия хлорид - 0,58 мг, натрия гидрофосфат дигидрат – 1,25 мг, натрия гидроксид 2М - около 2,2 мг, натрия гидрофосфат дигидрат – 1,25 мг, хлористоводородная кислота 2М - около 1,7 мг, вода для инъекций – до 1 мл.







