-
1. Показания для применения
РинЛиз® Микс 25 – это смесь протаминированного инсулина лизпро, препарата инсулина средней продолжительности действия, и инсулина лизпро, аналога инсулина человека ультракороткой продолжительности действия. РинЛиз® Микс 25 применяется у пациентов с сахарным диабетом, которым показана инсулинотерапия.
-
2. Режим введения и дозирование
a. Важные аспекты применения:
- До начала применения препарата РинЛиз® Микс 25 необходимо внимательно изучить инструкцию по медицинскому применению, прилагающуюся к данному препарату.
- РинЛиз® Микс 25 необходимо вводить в область передней брюшной стенки, бедра или плеча. Необходимо постоянно менять места введения препарата, это поможет избежать развития липодистрофий.
- Доза препарата РинЛиз® Микс 25 должна подбираться и корректироваться в соответствии с индивидуальными метаболическими потребностями, результатами определения уровня глюкозы в крови и индивидуальными гликемическими целями.
- Препарат РинЛиз® Микс 25 следует вводить за 15 минут до начала еды.
- Препарат РинЛиз® Микс 25 запрещено вводить внутривенно или с помощью продолжительных подкожных инфузий.
- Препарат РинЛиз® Микс 25, как правило, вводят два раза в сутки (одна доза препарата покрывает два приема пищи или один прием пищи и перекус).
-
3. Доступные лекарственные формы
РинЛиз® Микс 25, суспензия для подкожного введения 100 МЕ/мл, содержит 75 % протамина инсулина лизпро и 25 % инсулина лизпро.
-
4. Противопоказания
РинЛиз® Микс 25 противопоказан:
- Во время текущего эпизода гипогликемии.
- Пациентам с гиперчувствительностью к препарату РинЛиз® Микс 25 и его компонентам.
-
5. Меры предосторожности
- Не следует совместно с кем-либо использовать шприц-ручку или шприцы с препаратом РинЛиз® Микс 25.
Совместное применение препарата РинЛиз® Микс 25, даже при смене иглы, значительно увеличивает риск передачи инфекций (например, гепатит B, С, ВИЧ и другие).
- Гипергликемия и гипогликемия при изменении режима инсулинотерапии.
Изменение режима инсулинотерапии может оказывать влияние на гликемический контроль и предрасположенность к гипогликемии. Повторные инъекции в места липодистрофий могут приводить к гипергликемии, а внезапная смена места инъекции (на участок, в который ранее не вводили препарат) может приводить гипогликемии.
Внесение любых изменений в режим инсулинотерапии должно осуществляться под наблюдением специалиста в условиях адекватного мониторинга уровня гликемии. Пациенты, которые постоянно вводят препараты инсулина в зоны липодистрофии, должны быть проинструктированы о необходимости смены зон инъекций и возможных гипогликемиях при переходе. Пациентам с сахарным диабетом II типа может потребоваться коррекция дозы других противодиабетических препаратов.
Гипогликемии могут возникать при применении препаратов инсулина, в некоторых случаях эпизоды гипогликемии могут представлять угрозу для жизни. При изменении режима инсулинотерапии или питания, при изменении применения других сахароснижающих препаратов, при изменении физической активности, у пациентов с нарушением функции печени и почек, а также у пациентов, плохо ощущающих симптомы гипогликемии, рекомендуется более часто оценивать уровень глюкозы крови.
- Гипогликемии из-за ошибочного применения.
Перед каждым введением препарата РинЛиз® Микс 25 необходимо убедиться, что Вы вводите именно препарат РинЛиз® Микс 25. Известны случаи ошибочного применения препаратов инсулина, в частности, применение аналогов инсулина ультракороткой продолжительности действия вместо препаратов средней или длительной продолжительности действия. Избежать таких ошибок можно путем проверки маркировки препарата перед каждым его введением.
При применении препаратов инсулина могут возникнуть генерализованные жизнеугрожающие аллергические реакции, в том числе анафилактические реакции. В случае развития аллергических реакций при применении препарата РинЛиз® Микс 25 следует немедленно прекратить применение препарата и обратиться за медицинской помощью.
- Задержка жидкости и сердечная недостаточность при совместном применении с тиазолидиндионами.
Применение препаратов инсулина в сочетании с тиазолидиндионами может привести к появлению или прогрессированию симптомов сердечной недостаточности. При совместном применении препарата РинЛиз® Микс 25 с тиазолидиндионами необходимо следить за симптомами сердечной недостаточности. При необходимости следует рассмотреть возможность снижения дозы или отмены препаратов группы тиазолидиндионов.
-
6. Нежелательные реакции
Нежелательные реакции, которые могут возникнуть при использовании препарата РинЛиз® Микс 25, не отличаются от таковых при использовании любого другого препарата инсулина и обусловлены действием инсулина и белковой природой молекулы.
6.1. Гипогликемия
Гипогликемия – наиболее часто возникающая нежелательная реакции при терапии препаратом РинЛиз® Микс 25. Тяжелая гипогликемия может быть причиной судорог или потери сознания и представлять угрозу для жизни. Гипогликемия может приводить к снижению концентрации внимания и замедлению реакции: это может подвергнуть опасности как самого человека, получающего препарат, так и окружающих его людей (например, при вождении транспортных средств и работе со сложными механизмами). РинЛиз® Микс 25, как и любой другой препарат инсулина, не следует применять во время текущего эпизода гипогликемии.
Гипогликемическое состояние может возникнуть внезапно, симптомы гипогликемии могут отличаться у разных людей или могут меняться с течением времени у одного и того же человека. Симптомы гипогликемии могут быть менее выражены у пациентов с длительно существующим сахарным диабетом, у пациентов с диабетической нейропатией или при применении некоторых лекарственных препаратов (раздел 7).
Факторы риска развития гипогликемии:
Риск развития гипогликемии после выполнения инъекции препарата инсулина связан с профилем действия препарата и, как правило, выше при достижении его максимальной гипогликемической активности. У препарата РинЛиз® Микс 25, как и у других препаратов инсулина, профиль активности может отличаться у разных людей или у одного и того же пациента в разное время. Профиль активности зависит от многих факторов, включая место инъекции, степень его кровоснабжения и температуру. Риск гипогликемии возрастает с увеличением интенсивности гликемического контроля. Изменение режима питания (содержание макронутриентов, время приема пищи) и физической активности также может приводить к развитию гипогликемий. Кроме того, любые изменения в применении других лекарственных препаратов (прием новых препаратов, изменение дозы или частоты применения ранее используемых лекарственных средств) могут способствовать развитию гипогликемий. Лекарственные препараты, которые могут оказывать потенциальное влияние на развитие гипогликемий, представлены в разделе (раздел 7). Пациенты с нарушением функции печени и почек имеют более высокий риск гипогликемии.
Пути снижения риска возникновения гипогликемии
Пациенты и лица, осуществляющие уход за пациентами, должны уметь распознавать симптомы гипогликемии. Самоконтроль гликемии является одним из ключевых способов профилактики и контроля гипогликемии. Пациентам с высоким риском развития гипогликемий или пациентам со сниженной чувствительностью к симптомам гипогликемии следует более часто измерять уровень глюкозы крови.
6.2. Гиперчувствительность и аллергические реакции
Генерализованные аллергические реакции при лечении препаратом РинЛиз® Микс 25 возникают редко (≥1/10000, но <1/1000). Тяжелые угрожающие жизни случаи генерализованной аллергии, в частотности анафилактический шок, могут возникать при применении любых препаратов инсулина, в том числе препарата РинЛиз® Микс 25. Если при применении препарата РинЛиз® Микс 25 возникают аллергические реакции, необходимо прекратить его введение. Лечение аллергических реакций рекомендуется проводить с учетом актуальных стандартов лечения. РинЛиз® Микс 25 противопоказан пациентам с гиперчувствительностью к любым другим двухфазным препаратам инсулина лизпро или вспомогательным веществам препарата РинЛиз® Микс 25. Перечень вспомогательных веществ представлен в разделе 10.
6.3. Задержка жидкости и сердечная недостаточность при одновременном применении
с тиазолидиндионами
Тиазолидиндионы относятся к классу агонистов рецепторов, активирующих пролиферацию пероксисом-гамма (PPAR-γ). Препараты данной группы могут приводить к задержке жидкости в организме, особенно при сочетании с препаратами инсулина. Задержка жидкости может потенциально приводить к развитию или прогрессированию сердечной недостаточности. Пациентам, получающим одновременно РинЛиз® Микс 25 и тиазолидиндионы, рекомендуется контролировать появление симптомов сердечной недостаточности. При развитии сердечной недостаточности рекомендуется рассмотреть вопрос отмены тиазолидиндионов или снижения их дозы. Для лечения сердечной недостаточности рекомендуется использовать актуальные стандарты по оказанию медицинской помощи.
6.4. Реакции в местах введения
Применение препарата РинЛиз® Микс 25 может быть причиной покраснения, отека или зуда в месте его введения. Как правило, эти реакции проходят в течение нескольких дней или недель, однако в некоторых случаях может потребоваться отмена применения данного препарата. Препарат РинЛиз® Микс 25 в качестве вспомогательного вещества содержит в своем составе метакрезол, при применении метакрезола известны случаи реакций в местах введения, а также генерализованные миалгии. Метакрезол входит в состав многих препаратов инсулина.
6.5. Липодистрофия
Подкожное введение препаратов инсулина, в частности РинЛиз® Микс 25, может приводить к развитию липоатрофий (ямочки на поверхности кожи) или липогипертрофий (увеличение или утолщение тканей).
6.6. Увеличение массы тела
Препараты инсулина, в том числе РинЛиз® Микс 25, обладают анаболическим действием и способствуют снижению глюкозурии, что может приводить к увеличению массы тела.
6.7. Нежелательные реакции, ассоциированные с началом интенсивной инсулинотерапии
и контролем гликемии
Быстрое улучшение гликемического профиля может быть ассоциировано с кратковременным обратимым нарушениям зрения. Нарушение зрения может быть связано с нарушением рефракции или ухудшением течения диабетической ретинопатии. Кроме того, быстрое улучшение гликемического профиля может приводить к временному прогрессированию симптомов диабетической нейропатии, в том числе боли. Интенсивная инсулинотерапия у пациентов, которые ранее плохо контролировали уровень гликемии, может приводить к появлению периферических отеков, связанных с задержкой ионов натрия в организме. Долгосрочный гликемический контроль способствует снижению риска ретинопатии и нейропатии.
6.8. Безопасность препарата РинЛиз® Микс 25 в клинических исследованиях
Безопасность применения лекарственного препарата РинЛиз® Микс 25 изучалось в рамках двух клинических исследовани, проведенных ГЕРОФАРМ.
Перекрестное исследование фармакокинетики и фармакодинамики, в котором приняли участие здоровые добровольцы. Идентификационный номер исследования в системе ClinicalTrials.gov – NCT03606018. Данное исследование проводилось для оценки параметров фармакокинетики и фармакодинамики (раздел 9), однако в нем также оценивались и параметры безопасности применения препарата РинЛиз® Микс 25.
В исследовании приняли участие 49 здоровых добровольцев, из которых 48 участников были рандомизированы (включены в исследование). Средний возраст участников составил 26 лет, средний ИМТ – 24 кг/м2. Все участники исследования получили препарат РинЛиз® Микс 25 и референтный препарат инсулин гларгин в дозе 0.4 МЕ/кг. Данные о нежелательных реакциях в исследовании представлены в таблице 1. Нежелательные реакции – это нежелательные явления, возникновение которых имеет потенциальную связь с исследуемым препаратом.

Многоцентровое рандомизированное клиническое исследование иммуногенности, безопасности и эффективности препарата РинЛиз® Микс 25, в котором приняли участие пациенты с сахарным диабетом II типа. Идентификационный номер исследования в системе ClinicalTrials.gov – NCT04023344.
Клиническое исследование проведено с участием пациентов с сахарным диабетом II типа. Отбор в исследование (скрининг) прошли 257 участников, из которых были рандомизированы (включены в исследование) 210 пациентов. Средний возраст пациента составил 57 лет, а длительность диабета в среднем достигала 10 лет. 76% пациентов получали терапию инсулином до участия в исследовании. Среди участников исследования 67% были женщинами, 33% - мужчинами, средний ИМТ составил 31 кг/м2. Средний уровень HbA1c до начала лечения составил 9,4%. Длительность терапии препаратом РинЛиз® Микс 25 составила 30 недель, 4 недели из которых занял период титрации. В таблице 1 представлены данные по нежелательным реакциям, зарегистрированным в клиническом исследовании в группе, получающей терапию препаратом РинЛиз® Микс 25 в течение 30 недель. Нежелательные реакции – это нежелательные явления, возникновение которых имеет потенциальную связь с исследуемым препаратом.

Гипогликемии относятся
к наиболее частым нежелательным реакциям инсулинотерапии и связаны с механизмом
действия препарата. В настоящем исследовании эпизоды гипогликемии анализировались
отдельно как нежелательные реакции особого интереса. Данные по эпизодам
гипогликемии представлены в таблице 3.
Таблица 3. Данные об эпизодах гипогликемий в группе препарата РинЛиз® Микс 25 в исследовании NCT04023344.
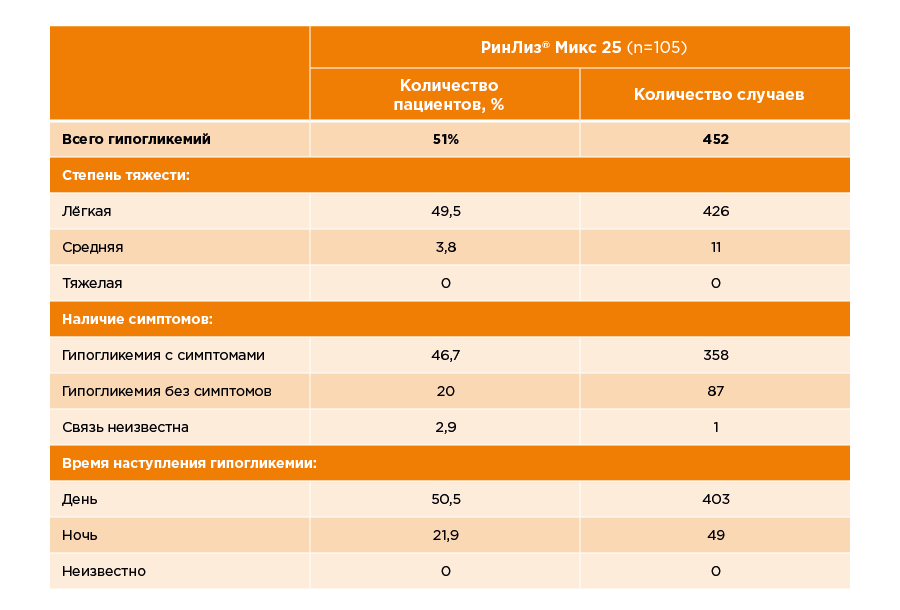
За время исследования у одного пациента зарегистрировали кожную реакцию в месте введения препарата.
За время исследования не было зарегистрировано ни одной системной аллергической реакции.
Иммуногенность препарата РинЛиз® Микс 25 в клинических исследованиях
Все препараты пептидного происхождения относятся к потенциально иммуногенным веществам.
В 30-недельном клиническом исследовании препарата РинЛиз® Микс 25 значимый уровень анти-инсулиновых антител зарегистрирован у 8,5% пациентов, получающих РинЛиз® Микс 25. Динамика концентрации антител носила разнонаправленный характер: в течение первых 12 недель терапии стабильными дозами препаратом РинЛиз® Микс 25 концентрация антител нарастает, а в течение последующих 12 недель – снижается. У большинства пациентов изменение концентрации антител происходило в диапазоне, не превышающем уровень определения иммунного ответа.
-
7. Лекарственные взаимодействия
Некоторые лекарственные препараты при
одновременном применении с препаратом РинЛиз® Микс 25 могут влиять на его
гипогликемическую эффективность.

-
8. Применение в особых популяциях пациентов
Особые популяции рассматриваются отдельно от остальной популяции, так как абсорбция, распределение, метаболизм и выведение лекарственных препаратов могут отличаться у некоторых групп людей. Например, у пациентов с хронической болезнью почек, ожидается замедленное выведение препарата. Изучение действия препарата инсулин лизпро и готовых смесей на его в особых популяциях выполнено в клинических исследованиях референтного препарата инсулин лизпро, 100 ME/мл и инсулин двухфазный, 100 ME/мл. В соответствии с Решением ЕАЭК №89 от 03.11.2019 г. и директивой Европейского Медицинского Агентства 2015 EMEA/CHMP/BMWP/32775/2005_Rev. 1 биосимиляр может применяться во всех популяциях, зарегистрированных для референтного препарата.
Ниже приведены данные по оригинальному препарату Хумалог® Микс 25 на особых популяциях пациентов, которые были экстраполированы* (перенесены) на РинЛиз® Микс 25 на основании доказанной высокой степени сходства молекулы, готовой лекарственной формы, эффективности и безопасности препарата.
Беременные женщины
На сегодняшний день имеются лишь ограниченные данные о применении референтного препарата инсулин лизпро двухфазный у беременных женщин. Однако в опубликованных исследованиях при применении референтного препарата инсулин лизпро, 100 ME/мл не установлено взаимосвязи между применением препарата инсулин лизпро и осложнениями течения беременности. Риски для матери и плода ассоциированы с плохо контролируемым во время беременности сахарным диабетом.
Контроль гликемии на протяжении всего периода беременности крайне важен для состояния здоровья ребенка. Плохой гликемический контроль во время беременности может негативно сказываться на ее течении и развитии плода. Расчетный риск возникновения врожденных пороков развития у женщин с сахарным диабетом, установленным до наступления беременности, при уровне HbA1c >7 % составляет 6-10 %, при уровне HbA1c >10 % риск возрастает до 20-25 %. Частота самопроизвольных абортов у женщин с сахарным диабетом неизвестна. В популяции в целом частота врожденных пороков развития составляет 2-4 %, частота самопроизвольных абортов составляет 15-20 %.
Кормящие женщины
Данные о наличии референтного препарата инсулин лизпро двухфазный 25 в грудном молоке, влиянии на ребенка на грудном вскармливании или влиянии на выработку молока отсутствуют. Эндогенный инсулин присутствует в грудном молоке.
Следует учитывать преимущества грудного вскармливания для развития и здоровья ребенка, а также клиническую потребность матери в препарате инсулина и любые потенциальные неблагоприятные последствия для ребенка на грудном вскармливании или состояния здоровья матери при применении препарата РинЛиз® Микс 25.
Дети
Безопасность препаратов, содержащих инсулин лизпро двухфазный 25, не исследовалась с участием детей и подростков младше 18 лет.
Пожилые пациенты
Клинические исследования референтного препарата инсулин лизпро двухфазный включали недостаточное количество пациентов старше 65 лет для определения различий профиля безопасности у данной популяции по сравнению с более молодыми пациентами. При применении препарата РинЛиз® Микс 25 у пожилых пациентов следует соблюдать осторожность.
Нарушение функции почек
Влияние значительного нарушения функции почек на фармакокинетику двухфазного инсулина лизпро, в том числе препарата РинЛиз® Микс 25, отдельно не изучалось. Некоторые исследования генно-инженерного инсулина человека установили более длительную циркуляцию в крови инсулина при нарушении функции почек.
При применении препарата РинЛиз® Микс 25 у пациентов с нарушением функции почек рекомендуется более частый мониторинг глюкозы крови и, при необходимости, изменение дозы препарата.
Нарушение функции печени
Влияние значительного нарушения функции почек на фармакокинетику двухфазного инсулина лизпро, в том числе препарата РинЛиз® Микс 25, отдельно не изучалось. Более частый мониторинг глюкозы и коррекция дозы могут быть необходимы при применении препаратов инсулина, включая препарат РинЛиз® Микс 25, у пациентов с нарушениями функции печени.
-
9. Передозировка
Для препаратов инсулина строго не определена доза, которая может быть использована для регистрации передозировки. Передозировку следует рассматривать как избыточное введение препарата инсулина относительно количества потребленной пищи и расхода энергии.
Последствием избыточного введения препарата может быть развитие гипогликемии и гипокалиемии. Легкие эпизоды гипогликемии могут быть купированы пероральным приемом глюкозы или пищи с высоким содержанием глюкозы. Передозировка (превышение количества введенного инсулина над потребностью в инсулине) может потребовать коррекции дозы, режима питания или физической активности. Более тяжелые эпизоды гипогликемии, сопровождающиеся потерей сознания и неврологическими нарушениями, могут потребовать внутримышечного/подкожного введения глюкагона или внутривенного введения концентрированного раствора глюкозы. Может потребоваться длительное потребление углеводов и наблюдение, потому что гипогликемия может развиться вновь после купирования. Коррекция гипокалиемии проводится только квалифицированным медицинским персоналом с помощью введения препаратов, содержащих калий.
-
10. Описание
РинЛиз® Микс 25 – смесь 75 % протамина инсулина лизпро, инсулина средней продолжительности действия, и 25 % инсулина лизпро, аналога инсулина человека ультракороткой продолжительности действия. Инсулин лизпро получают путем технологии рекомбинантной ДНК, используя непатогенный лабораторный штамм Escherichia coli. Инсулин лизпро состоит из двух аминокислотных цепей: A и B. Цепь А состоит из 21 аминокислоты, внутри цепи имеется одна дисульфидная связь, цепь B состоит из 30 аминокислот. Цепь А и B связаны между собой двумя дисульфидными связями. Инсулин лизпро отличается от инсулина человека двумя аминокислотными заменами: пролин в положении B28 заменен на лизин, а лизин в положении B29 – на пролин (показаны на рисунке белым цветом). Эмпирическая формула инсулина лизпро имеет следующий вид: C257H383N65O77S6. Молекулярная масса составляет 5807.57 Да. Структурная формула препарата инсулин лизпро представлена на рисунке:

РинЛиз® Микс 25 – суспензия белого цвета, которая расслаивается, образуя белый осадок и прозрачную бесцветную или почти бесцветную надосадочную жидкость. Осадок легко ресуспендируется при легком встряхивании. В 1 мл препарата содержится инсулин лизпро – 100 ME (эквивалентно 3,47 мг), вспомогательные вещества: метакрезол – 1,76 мг, фенол кристаллический – 0,715 мг, глицерол – 16,00 мг, протамина сульфат – 0,28 мг, натрия гидрофосфат гептагидрат – 3,78 мг, , цинка оксид – до содержания Zn2+ не более 25 мкг/мл, хлористоводородная кислота 10 % и/или натрия гидроксида раствор 10 % - до pH 7,0-7,8, вода для инъекций – до 1 мл.
-
11. Клиническая фармакология
11.1. Механизм действия
Инсулин действует через специфические рецепторы, связанные с мембраной клеток органов-мишеней. Действие препарата направлено на регуляцию метаболизма углеводов, белков и жиров. К органам-мишеням инсулина относятся печень, скелетная мышечная ткань и жировая ткань.
В печени инсулин стимулирует синтез гликогена. Инсулин также способствует синтезу жирных кислот в печени, которые секретируются в кровь в виде липопротеинов. В скелетных мышцах инсулин увеличивает синтез белка и гликогена. В жировой ткани инсулин стимулирует превращение липопротеинов в жирные кислоты и триглицериды. Кроме того, инсулин препятствует разрушению триглицеридов в жировой ткани. Инсулин стимулирует поглощение клетками аминокислот и некоторых ионов, например, ионов калия, магния и фосфатов.
Фармакокинетика и фармакодинамика препарата РинЛиз® Микс 25 были изучены в ходе перекрестного эугликемического клэмп-исследования, проведенного ГЕРОФАРМ (см пункт 9.2 и 9.3)
11.2. Фармакодинамика
Фармакодинамический профиль препарата РинЛиз® Микс 25 определили при подкожном введении в дозе 0.4 МЕ/кг в ходе перекрестного исследования фармакокинетики и фармакодинамики (гиперинсулинемического эугликемического клэмп-исследования) – NCT03606018. В исследовании NCT03606018 приняли участие 48 здоровых добровольцев (было скринировано 49 добровольцев). Средний возраст участника составил 26 лет, средний ИМТ – 24 кг/м2. Средняя суммарная площадь под кривой «скорость инфузии глюкозы-время» в интервале от начала до окончания дозировочного интервала (AUCGIR0-τ) составила 48,16 мг/кг×60. Средняя максимальная скорость инфузии глюкозы (GIRmax) составила 8,69 мг/кг/мин. Время до максимального эффекта препарата (tGIRmax) составило 3,13 ч. Среднее время между введением препарата и началом инфузии глюкозы (tGIRlag) составило 0,49 ч Ниже представлен график усредненных фармакодинамических кривых после подкожного введения препарата РинЛиз® Микс 25 и референтного двухфазного инсулина лизпро 25, 100 МЕ/мл.

По результатам исследования оцениваемые параметры фармакодинамики препарата РинЛиз® Микс 25 и референтного препарата инслулин лизпро двухфазный 25 сопоставимы.
11.3. Фармакокинетика
Фармакокинетический профиль препарата РинЛиз® Микс 25 определен в ходе перекрестного эугликемического гиперинсулинемического клэмп-исследования с участием 49 здоровых добровольцев при однократном подкожном введении препарата в дозе 0,4 ME/кг. Средняя суммарная площадь под кривой «концентрация исследуемого инсулина - время» в интервале времени от 0 до конца дозировочного интервала (AUCins.0-τ) составила 1214,74 пмоль /л×ч. Средняя максимальная концентрация препарата РинЛиз® Микс 25 (Cmax) составила 238,75 пмоль/л. Среднее время достижения максимальной концентрации (tmax) составило 1,58 ч. Средний период полувыведения (t1/2) составил 3,47 ч. Ниже представлены усреднённые фармакокинетические профили концентрации инсулина лизпро в плазме крови участников после подкожного введения препарата РинЛиз® Микс 25 и референтного двухфазного инсулина лизпро25, 100 ME/мл.
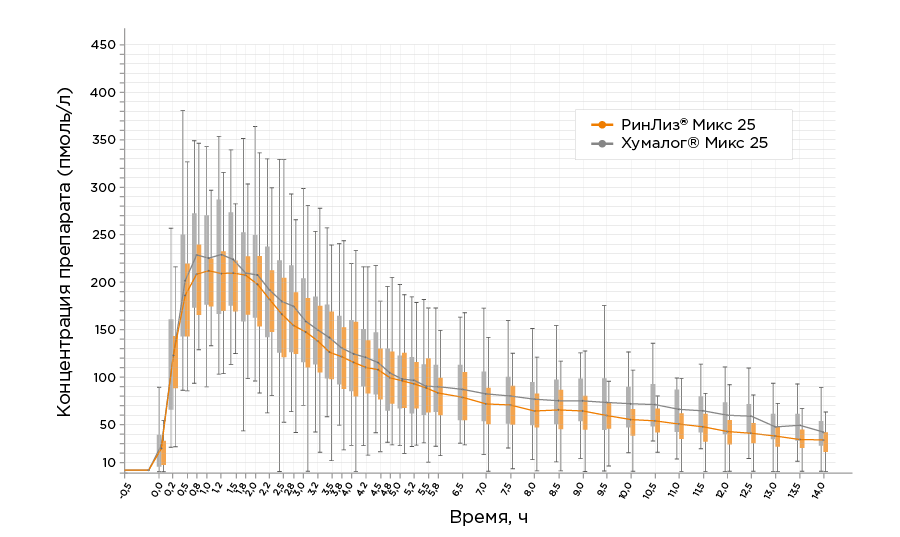
По результатам исследования оцениваемые
параметры фармакокинетики препарата РинЛиз® Микс 25 и референтного препарата инслулин
лизпро двухфазный 25 сопоставимы.
-
12. Клинические исследования
Безопасность и эффективность референтного препарата инсулин лизпро двухфазный 25, 100 МЕ/мл, была подтверждена в ходе трех клинических исследований с участием взрослых пациентов с сахарным диабетом II типа (общее количество участников составило 2971 пациентов). В данных исследованиях оценивалась эффективность и безопасность референтного препарата лизпро двухфазный 25 в качестве препарата для стартовой инсулинотерапии, а также для интенсификации инсулинотерапии. В данных исследованиях референтный препарат инсулин лизпро двухфазный 25 сравнивался с инсулинами длительного действия, инсулинами длительного действия в комбинации с инсулинами короткой продолжительности действия, а также с другими двухфазными инсулинами.
ГЕРОФАРМ проводил исследования безопасности и эффективности препарата РинЛиз® Микс 25 в сравнении с оригинальным препаратом, чтобы доказать сопоставимость фармакологических параметров, эффективности и безопасности препаратов. Подробное описание таких исследований приведено ниже.
Исследования РинЛиз® Микс 25
Многоцентровое рандомизированное клиническое исследование иммуногенности, эффективности и безопасности препарата РинЛиз® Микс 25 выполнено с участием пациентов с сахарным диабетом II типа (NCT04023344). Средний возраст пациентов в исследовании составил 57 лет, а длительность диабета в среднем достигала 10 лет. 76% пациентов получали терапию инсулином до включения в исследование. Среди участников исследования 67 % были женщинами, 33 % мужчинами, средний ИМТ составил 31 кг/м2. Средний уровень HbA1c до начала лечения составил 9,4 %. Длительность терапии препаратом РинЛиз® Микс 25 составила 30 недель, 4 недели из которых занял период титрации.
В среднем, в течение исследования уровень гликированного гемоглобина снизился на 1,6 %. Разница средних динамики гликированного гемоглобина составила 0,01%. При лечении препаратом РинЛиз® Микс 25 около четверти пациентов достигли уровня HbA1c≤ 7 %. Общая информация об эффективности представлена в таблице ниже.
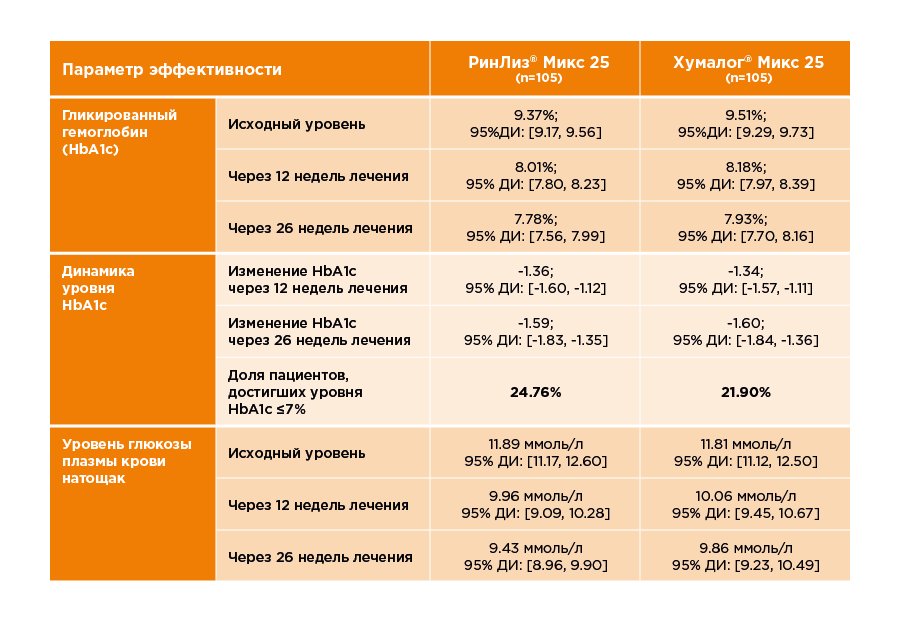
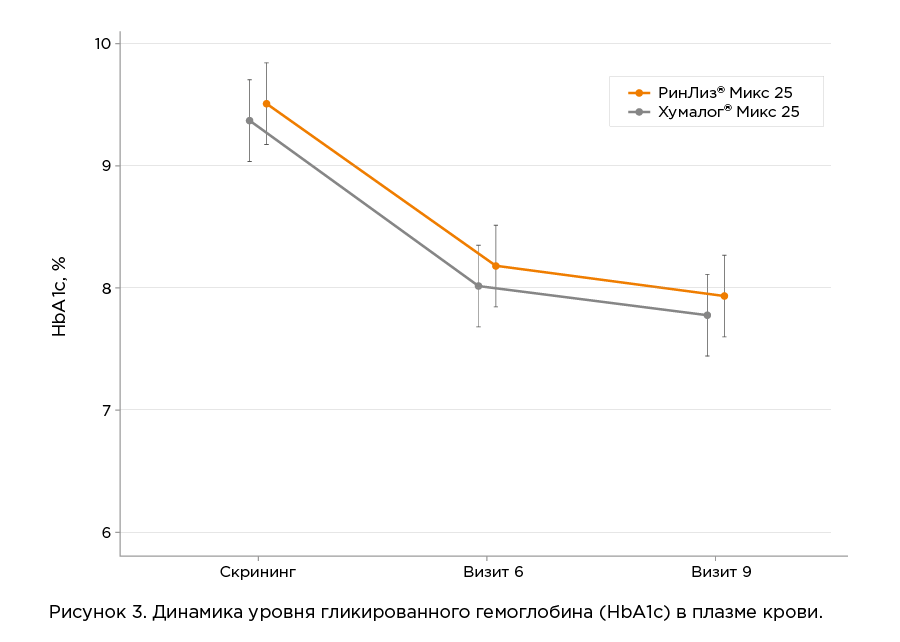

По результатам исследования по параметрам эффективности препарат РинЛиз® Микс 25 и референтный препарат инсулин лизпро двухфазный 25 сопоставимы.
Эффективность двухфазного инсулина лизпро 25 у пациентов с сахарным диабетом II типа (данные исследований референтного препарата Хумалог® Микс 25 в сравнении с двухфазным инсулином человека, результаты актуальны для препарата РинЛиз® Микс 25 на основании научного принципа экстраполяции* (перенос данных).
В перекрестном клиническом исследовании референтного инсулина лизпро двухфазный 25 приняли участие 89 пациентов с сахарным диабетом II типа. Исследование состояло из двух периодов: в течение одного периода пациенты получали двухфазный инсулин человека 30, в течение другого - двухфазный инсулин лизпро 25. Оба препарата пациенты вводили дважды в день перед едой. Длительность исследования составила 6 месяцев. Препараты были сопоставимы по влиянию на уровень гликированного гемоглобина и по частоте гипогликемий. У пациентов во время применения двухфазного инсулина лизпро 25 постпрандиальная гликемия после завтрака и ужина была ниже, чем во время применения двухфазного инсулина человека 30.
*Экстраполяция — это устоявшийся научный принцип, который применяется в фармацевтике и предполагает перенос результатов исследований на другие показания применения препарата или группы пациентов на основании проведенных исследований сопоставимости.
-
13. Условия хранения
Препарат до начала использования следует хранить в холодильнике при температуре от 2 °C до 8 °C, препарат после начала использования следует хранить при комнатной температуре (не выше 30 °C) в защищенном от света или перегревания месте.
Не следует замораживать препарат РинЛиз® Микс 25. Также не следует использовать замороженный ранее препарат РинЛиз® Микс 25. Не следует использовать препарат РинЛиз® Микс 25 после окончания срока годности.
Шприц-ручку препарата РинЛиз® Микс 25 необходимо использовать в течение 28 дней. По истечении 28 дней использования шприц-ручки ее необходимо утилизировать даже в том случае, если в ней осталась часть препарата.

-
14. Информация для консультации пациентов
Не следует передавать шприц-ручку для использования другим людьми.
Следует сообщить пациенту, что совместное использование шприц-ручки с другими людьми, даже при смене иглы, может привести к передаче различных инфекционных заболеваний.
Гипергликемия и гипогликемия
Пациента следует уведомить о том, что гипогликемия является наиболее частой нежелательной реакцией при использовании инсулина. Следует сообщить пациенту, как проявляются симптомы гипогликемии. Следует объяснить пациенту, что при возникновении гипогликемии может снижаться способность к концентрации внимания и быстрота реакции, это может быть опасно при вождении автомобиля или работе со сложными механизмами.
Также пациенту следует сообщить, что изменение режима инсулинотерапии может приводить к гипер- или гипогликемиям. Изменение режима инсулинотерапии следует выполнять под контролем лечащего врача.
Ошибочное введение
Следует рассказать пациенту о необходимости проверки названия препарата перед каждым его использованием.
Действия пациента в особых ситуациях
Пациенты должны быть обучены методам самостоятельного мониторинга глюкозы, технике инъекций инсулина, способам купирования гипогликемий и гипергликемий. Пациенты должны знать о мерах, которые они должны предпринять в случае развития сопутствующих заболеваний или стресса, в случае пропуска инъекции или введения неадекватной дозы, в случае пропуска приема пищи или неадекватного приема пищи.
-
15. Информация для пациентов














