-
1. Показания к применению
РинЛиз® – аналог инсулина человека ультракороткого действия. РинЛиз® применяется для лечения детей и взрослых с сахарным диабетом с целью поддержания нормального уровня глюкозы крови при наличии показаний к лечению препаратами инсулина.
-
2. Режим дозирования и путь введения
Доза препарата должна определяться лечащим врачом индивидуально для каждого пациента в зависимости от потребности в инсулине.
РинЛиз® при подкожном введении начинает действовать быстрее, чем генно-инженерный инсулин человека, поэтому его можно вводить незадолго до приема пищи, как правило, за 15 минут до еды. При необходимости РинЛиз® можно ввести непосредственно после приема пищи.
Продолжительность действия препарата РинЛиз® короче, чем у генно-инженерного инсулина человека (короткого действия), и составляет от 2 до 5 часов. Продолжительность действия препарата РинЛиз® может отличаться у разных людей или у одного и того же человека. Например, продолжительность действия зависит от места инъекции, степени его кровоснабжения, температуры и физической активности.
РинЛиз® может использоваться в комбинации с другими сахароснижающими препаратами (не относящимися к инсулинам), длительно действующими препаратами инсулина в составе базис-болюсной/базал-болюсной инсулинотерапии или в системах постоянной подкожной инфузии инсулина.
Подкожные инъекции препарата РинЛиз®
Подкожные инъекции необходимо выполнять в область живота, ягодиц, наружных поверхностей плеча или бедра. Места инъекций необходимо чередовать таким образом, чтобы одно и то же место не использовалось чаще одного раза в месяц. После введения препарата не следует массировать место инъекции.
Необходимо строго соблюдать технику введения препарата во избежание попадания лекарственного средства непосредственно в кровеносный сосуд. Для обучения и контроля техники введения следует обратиться к лечащему врачу.
Постоянная подкожная инфузия препарата РинЛиз®
Перед началом постоянной подкожной инфузии инсулина с помощью инсулиновой помпы необходимо проконсультироваться с лечащим врачом. Перед началом использования препарата РинЛиз® в режиме постоянной подкожной инфузии необходимо убедиться, что инфузионная система зарегистрирована в установленном порядке. Внимательно изучите и строго следуйте инструкции производителя инсулиновой помпы. Инфузионный набор следует менять в соответствии с инструкцией производителя данного набора. Неисправность инсулиновой помпы или закупорка инфузионной системы могут привести к быстрому повышению уровня глюкозы в плазме крови. Если у Вас есть подозрение на прекращение инфузии инсулина, то следуйте инструкции по использованию Вашей инсулиновой помпы и, при необходимости, сообщите об этом лечащему врачу.
При использовании препарата РинЛиз® в системе постоянной подкожной инфузии инсулина его не следует смешивать с другими препаратами инсулина.
Внутривенная инфузия препарата РинЛиз®
Внутривенное введение препарата РинЛиз® может осуществляться только медицинским персоналом в условиях адекватного мониторинга уровня глюкозы и ионов калия в плазме крови.
-
3. Доступные лекарственные формы, дозировка и формы выпуска препарата
Лекарственная форма: Раствор для внутривенного и подкожного введения.
Дозировка: 100 МЕ/мл.
Формы выпуска:
- Картриджи объемом 3 мл в картонной упаковке (5 шт./уп)
- Предзаполненные шприц-ручки объемом 3 мл в картонной упаковке (5 шт./уп)
-
4. Противопоказания
Гиперчувствительность к инсулину лизпро (подробное описание смотрите в разделе 9) или любым вспомогательным веществам в его составе.
Гипогликемия (препарат нельзя вводить во время эпизодов гипогликемии).
-
5. Нежелательные реакции
Нежелательные реакции, которые могут возникнуть при использовании инсулина РинЛиз®, не отличаются от таковых при использовании любого другого препарата инсулина и обусловлены действием инсулина и белковой природой молекулы.
5.1. Гипогликемия
Эпизоды гипогликемии чаще других нежелательных реакций встречаются у пациентов, получающих терапию препаратами инсулина. Тяжелая гипогликемия может привести к потере сознания, а в некоторых случаях к смерти пациента. На вероятность возникновения гипогликемий влияют различные факторы, включая дозу инсулина, режим питания и диету, а также уровень физической активности.
5.2. Местные аллергические реакции
У части пациентов встречаются местные аллергические реакции (≥1/100, но <1/10). Они проявляются покраснением, отеком и зудом в месте введения препарата. Как правило, они развиваются в течение нескольких дней или даже недель. В ряде случаев возникновение таких реакций связано с неправильной техникой введения и средствами личной гигиены.
5.3. Системные аллергические реакции
В редких случаях при введении инсулина может развиться системная аллергическая реакция (≥1/10 000, но <1/1 000). Системные аллергические реакции проявляются высыпаниями по всему телу, одышкой, снижением артериального давления, повышенной частотой сердечных сокращений и потоотделением. При развитии такой реакции пациенту следует незамедлительно обратиться к врачу, вызвав скорую медицинскую помощь.
5.4. Липодистрофия
Относительно редко (≥1/1 000, но <1/100) в местах инъекций возникают липодистрофии – изменения (например, уплотнения) в подкожной жировой клетчатке, которые можно определить на ощупь. Для предотвращения развития липодистрофий необходимо регулярно менять места инъекций и соблюдать технику инъекций.
5.5. Отеки
При терапии инсулином иногда возникают отеки. Вероятность их возникновения повышается, если пациенты с плохим гликемическим контролем начинают интенсивную инсулинотерапию. Отеки проходят самостоятельно при нормализации гликемического контроля. У некоторых пациентов при одновременном применении препаратов инсулина с тиазолидиндионами (пиоглитазон, росиглитазон) могут возникнуть или усугубиться симптомы сердечной недостаточности (одышка, отеки лодыжек и голени, быстрый набор веса). При возникновении или развитии симптомов сердечной недостаточности при одновременном применении препарата РинЛиз® и тиазолидиндионов необходимо обраться к лечащему врачу.
5.6. Безопасность препарата РинЛиз® в клинических исследованиях
Для биологических препаратов ключевым параметром безопасности считается их иммуногенность. Иммуногенность – способность препарата вызывать иммунный ответ со стороны организма человека. Как правило, при возникновении иммунного ответа к лекарственному препарату формируются антитела, которые потенциально могут влиять на эффективность и безопасность его применения. Иммуногенность аналогов инсулина человека и генно-инженерного инсулина обычно не оказывает влияния на безопасность или эффективность применения препаратов инсулина. Тем не менее иммуногенность препаратов линейки РинЛиз® была изучена в ходе сравнительного клинического исследования, проведенного ГЕРОФАРМ. Действующим веществом препаратов РинЛиз® и РинЛиз® Микс 25 является инсулин лизпро. Безопасность обоих препаратов изучалась в клиническом исследовании РинЛиз® Микс 25 как наиболее потенциально иммуногенного препарата в линейке препаратов с активным действующим веществом инсулин лизпро. Потенциально большая иммуногенность препарата РинЛиз® Микс 25 связана с наличием в его составе дополнительного белка протамина.
Кроме того, безопасность препарата РинЛиз® изучалась в ходе двойного слепого рандомизированного перекрестного клэмп-исследования с участием 28 здоровых добровольцев (в исследование скринирован 31 доброволец). Все добровольцы получили препарат РинЛиз® подкожно в дозе 0,3 МЕ/кг. В ходе исследования у одного добровольца возникло нежелательное явление – острое респираторное заболевание.
Данные клинического исследования безопасности с акцентом на иммуногенность, проведенного ГЕРОФАРМ
Клиническое исследование проведено с участием пациентов с сахарным диабетом II типа. Отбор в исследование (скрининг) прошли 257 участников, из которых рандомизировали (включили в исследование) 210 пациентов. Средний возраст пациента составил 57 лет, при этом, в исследовании принимали участие люди в возрасте от 37 до 65 лет, а длительность диабета в среднем достигала 10 лет. 76 % пациентов получали терапию инсулином до участия в исследовании. Среди участников исследования 67 % были женщинами, 33 % - мужчинами, средний ИМТ составил 31 кг/м2. Средний уровень HbA1c до начала лечения составил 9,4%. Длительность терапии препаратом РинЛиз® составила 30 недель, 4 недели из которых занял период титрации. В таблице 1 представлены данные по нежелательным реакциям, зарегистрированным в клиническом исследовании в группе, получающей терапию препаратом РинЛиз® Микс 25 в течение 30 недель. Нежелательные реакции – это нежелательные явления, возникновение которых имеет потенциальную связь с исследуемым препаратом.
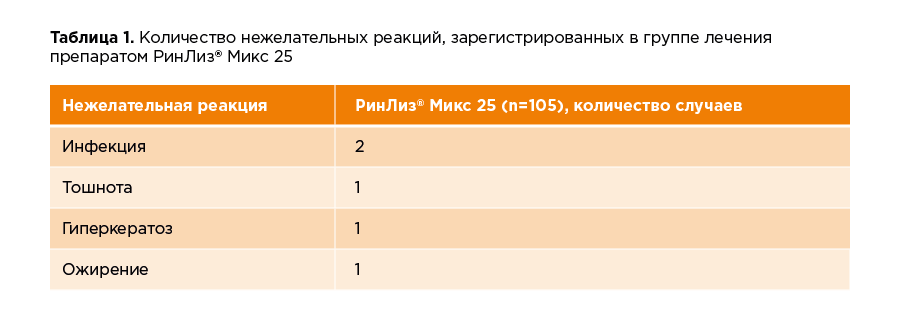
Гипогликемии считаются самой частой нежелательной реакцией при терапии препаратами инсулина, анализ эпизодов гипогликемий был выполнен отдельно от других нежелательных реакций. Регистрация эпизодов гипогликемий производилась по данным самоконтроля гликемии пациентом (глюкометром) или по данным оценки в центральной лаборатории (анализ плазмы крови). Все пациенты выполняли самоконтроль гликемии с помощью портативного глюкометра на протяжении всего исследования, кроме того, три раза в течение исследования пациенты выполняли 7-ми точечный тест гликемии, а на 12 и 26 неделях лечения стабильными дозами оценка уровня глюкозы в плазме крови выполнялась в центральной лаборатории. Результаты по зарегистрированным эпизодам гипогликемий представлены в таблице 2:

За время исследования у одного пациента зарегистрировали кожную реакцию в месте введения препарата.
За время исследования не было зарегистрировано ни одной системной аллергической реакции.
Иммуногенность препарата РинЛиз® в клинических исследованиях, проведенных ГЕРОФАРМ
Все препараты пептидного происхождения относятся к потенциально иммуногенным веществам.
В 30-недельном клиническом исследовании препарата РинЛиз® Микс 25 значимый уровень анти-инсулиновых антител зарегистрирован у 8,5% пациентов, получающих РинЛиз® Микс 25. Динамика концентрации антител носила разнонаправленный характер: в течение первых 12 недель терапии стабильными дозами препаратом РинЛиз® Микс 25 концентрация антител нарастает, а в течение последующих 12 недель – снижается. У большинства пациентов изменение концентрации антител происходило в диапазоне, не превышающем уровень определения иммунного ответа. Потенциальная иммуногенность препарата РинЛиз® ниже, чем у препарата РинЛиз® Микс 25, так как в нем отсутствует дополнительный белок протамин.
-
6. Взаимодействие с другими лекарственными препаратами
Некоторые лекарственные препараты при одновременном применении могут изменять действие друг друга. Перед началом применения препаратов инсулина следует сказать лечащему врачу о других принимаемых лекарственных средствах. При назначении любых лекарственных препаратов необходимо уведомить врача о текущем применении препаратов инсулина.
Ниже приведен перечень препаратов, которые могут влиять на действие препаратов инсулина и возможные меры по минимизации последствий этого взаимодействия.

-
7. Особые популяции пациентов
Особые популяции рассматриваются отдельно от остальной популяции, так как абсорбция, распределение, метаболизм и выведение лекарственных препаратов могут отличаться у некоторых групп людей. Например, у пациентов с хронической болезнью почек, ожидается замедленное выведение препарата.
Изучение действия препарата инсулин лизпро в особых популяциях выполнено в клинических исследованиях референтного препарата Хумалог (инсулин лизпро, 100 ME/мл). В соответствии с Решением ЕАЭК №89 от 03.11.2019 г. и директивой Европейского Медицинского Агенства 2015 EMEA/CHMP/BMWP/32775/2005_Rev. 1 биосимиляр может применяться во всех популяциях, зарегистрированных для референтного препарата.
Ниже приведены данные исследований референтного препарата Хумалог® в особых популяциях пациентов, которые были экстраполированы (перенесены) на РинЛиз® на основании доказанной высокой степени сходства молекулы, готовой лекарственной формы, эффективности и безопасности препарата.
Беременные женщины
На сегодняшний день накоплен большой опыт применения препарата инсулин лизпро у женщин на различных сроках беременности (более 1000 исходов беременности). Наблюдения не показали какого-либо неблагоприятного воздействия препарата инсулин лизпро на течение беременности, организм женщины или плода.
Контроль гликемии на протяжении всего периода беременности крайне важен для состояния здоровья ребенка. Плохой гликемический контроль во время беременности может негативно сказываться на ее течении и развитии плода. Расчетный риск возникновения врожденных пороков развития у женщин с сахарным диабетом, установленным до наступления беременности, при уровне HbA1c >7 % составляет 6-10 %, при уровне HbA1c >10 % риск возрастает до 20-25 %. Частота самопроизвольных абортов у женщин с сахарным диабетом неизвестна. В популяции в целом частота врожденных пороков развития составляет 2-4 %, частота самопроизвольных абортов составляет 15-20 %.
О планировании беременности или ее наступлении следует сообщить лечащему врачу.
Потребность в препаратах инсулина может меняться в течение беременности: в первом триместре потребность в инсулине обычно снижается, а во втором и третьем возрастает.
Кормящие женщины
Вероятно, что инсулин лизпро, как и генно-инженерный инсулин человека, попадает в грудное молоко. Препарат инсулин лизпро является полипептидом и должен разрушаться в кишечнике ребенка, поэтому препарат инсулин лизпро не должен оказывать неблагоприятное воздействие на состояние здоровья ребенка, находящегося на грудном вскармливании.
Применение препарата инсулин лизпро при кормлении грудью может потребовать дополнительного подбора дозы препарата и диеты.
Дети
Как и у взрослых, доза препарата инсулин лизпро подбирается для детей индивидуально в зависимости от метаболических потребностей.
С участием педиатрической популяции было выполнено два клинических исследования препарата инсулин лизпро. В одном исследовании принимали участие дети (61 пациент в возрасте 2-11 лет), в другом – дети и подростки (481 пациент в возрасте 9-19 лет). В каждом из исследований инсулин лизпро сравнивали с растворимым генно-инженерным инсулином человека. В результате было показано, что фармакодинамические характеристики препарата инсулин лизпро у детей соответствуют таковым у взрослых людей.
Пожилые пациенты
В клинических исследованиях препарата инсулин лизпро приняли участие свыше 338 пациентов в возрасте 65 лет и старше. Большинство из этих пациентов были с установленным диагнозом сахарного диабета II типа. В результате исследований было показано, что возраст пациентов не оказывает влияния на динамику уровня HbA1c и частоту гипогликемий.
Пациенты с нарушенной функцией почек
У пациентов с нарушенной функцией почек может быть повышенный риск гипогликемий. Часто у пациентов с заболеваниями почек требуется снижение дозы препаратов инсулина.
Пациенты с нарушенной функцией печени
Потребность в инсулине может снижаться у пациентов с печеночной недостаточностью в связи с пониженной способностью к глюконеогенезу и замедлением расщепления инсулина; однако, у пациентов с хронической печеночной недостаточностью повышенная инсулинорезистентность может привести к увеличению потребности в инсулине.
-
8. Передозировка
Для препаратов инсулина строго не определена доза, которая может быть использована для регистрации передозировки. Передозировку следует рассматривать как избыточное введение препарата инсулина относительно количества потребленной пищи и расхода энергии.
Последствием избыточного введения препарата может быть развитие гипогликемии и гипокалиемии. Легкие эпизоды гипогликемии могут быть купированы пероральным приемом глюкозы или пищи с высоким содержанием глюкозы. Передозировка (превышение количества введенного инсулина над потребностью в инсулине) может потребовать коррекции дозы, режима питания или физической активности. Более тяжелые эпизоды гипогликемии, сопровождающиеся потерей сознания и неврологическими нарушениями, могут потребовать внутримышечного/подкожного введения глюкагона или внутривенного введения концентрированного раствора глюкозы. Может потребоваться длительное потребление углеводов и наблюдение, потому что гипогликемия может развиться вновь после купирования. Коррекция гипокалиемии проводится только квалифицированным медицинским персоналом с помощью введения препаратов, содержащих калий.
-
9. Описание
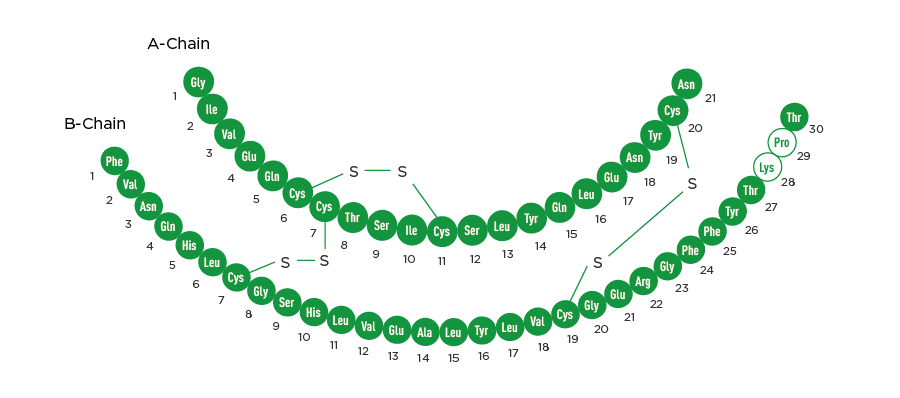
РинЛиз® (инсулин лизпро) – аналог инсулина человека ультракороткого действия. РинЛиз® получают путем технологии рекомбинантной ДНК, используя непатогенный лабораторный штамм Escherichia coli. РинЛиз® состоит из двух аминокислотных цепей: A и B. Цепь А состоит из 21 аминокислоты, внутри цепи имеется одна дисульфидная связь, цепь B состоит из 30 аминокислот. Цепь А и B связаны между собой двумя дисульфидными связями. Инсулин лизпро отличается от инсулина человека двумя аминокислотными заменами: пролин в положении B28 заменен на лизин, а лизин в положении B29 – на пролин (показаны на рисунке белым цветом). Эмпирическая формула препарата РинЛиз® имеет следующий вид: C257H383N65O77S6. Молекулярная масса составляет 5807.57 Да. Структурная формула препарата РинЛиз® представлена на рисунке:
РинЛиз® – стерильный, прозрачный и бесцветный раствор. В 1 мл препарата содержится инсулин лизпро – 100 ME (эквивалентно 3,47 мг), вспомогательные вещества: глицерол – 16,00 мг, натрия гидрофосфат гептагидрат – 1,88 мг, метакрезол – 3,15 мг, цинка оксид – до содержания Zn2+ 19,7 мкг/мл, 10% хлористоводородная кислота и/или натрия гидроксида раствор 10% - до pH 7,0-8,0, вода для инъекций – до 1 мл.
-
10. Клиническая фармакология
Инсулин действует через специфические рецепторы, связанные с мембраной клеток органов-мишеней. Действие препарата направлено на регуляцию метаболизма углеводов, белков и жиров. К органам-мишеням инсулина относятся печень, скелетная мышечная ткань и жировая ткань.
В печени инсулин стимулирует синтез гликогена. Инсулин также способствует синтезу жирных кислот в печени, которые секретируются в кровь в виде липопротеинов. В скелетных мышцах инсулин увеличивает синтез белка и гликогена. В жировой ткани инсулин стимулирует превращение липопротеинов в жирные кислоты и триглицериды. Кроме того, инсулин препятствует разрушению триглицеридов в жировой ткани. Инсулин стимулирует поглощение клетками аминокислот и некоторых ионов, например, ионов калия, магния и фосфатов.
Фармакокинетика и фармакодинамика препарата РинЛиз® были изучены в ходе перекрестного эугликемического клэмп-исследования, проведенного ГЕРОФАРМ (см пункт 10.1 и 10.2).
10.1. Фармакодинамика
Фармакодинамический профиль препарата РинЛиз® определен в ходе перекрестного эугликемического клэмп-исследования с участием 28 здоровых добровольцев (в исследование скринирован 31 доброволец) при однократном подкожном введении препарата в дозе 0,3 ME/кг. Время до максимального эффекта препарата (tGIRmax) составило 122 минуты. Средняя площадь под кривой скорости инфузии глюкозы (AUCGIR0-8,5) составила 3077 мг/кг. Средняя максимальная скорость инфузии глюкозы (GIRmax) составила 12,6 мг/кг. Средняя лощадь под кривой скорости инфузии глюкозы в течение первого часа (AUCGIR0-1) составила 259 мг/кг, в течение первых двух часов (AUCGIR0-2) – 868 мг/кг.

По результатам исследования оцениваемые параметры фармакодинамики препарата РинЛиз® и референтного препарата Хумалог® сопоставимы.
10.2. Фармакокинетика
Фармакокинетический профиль препарата РинЛиз® определен в ходе перекрестного эугликемического клэмп-исследования с участием 28 здоровых добровольцев (в исследование скринован 31 доброволец) при однократном подкожном введении препарата в дозе 0,3 ME/кг. Время достижения максимальной концентрации препарата (tmax) после подкожного введения составило 67,5 мин. Максимальная концентрация инсулина составила 678,5 пмоль/л. Площадь под кривой концентрации инсулина (AUCins.0-8) составила 104802 пмоль/лхч.
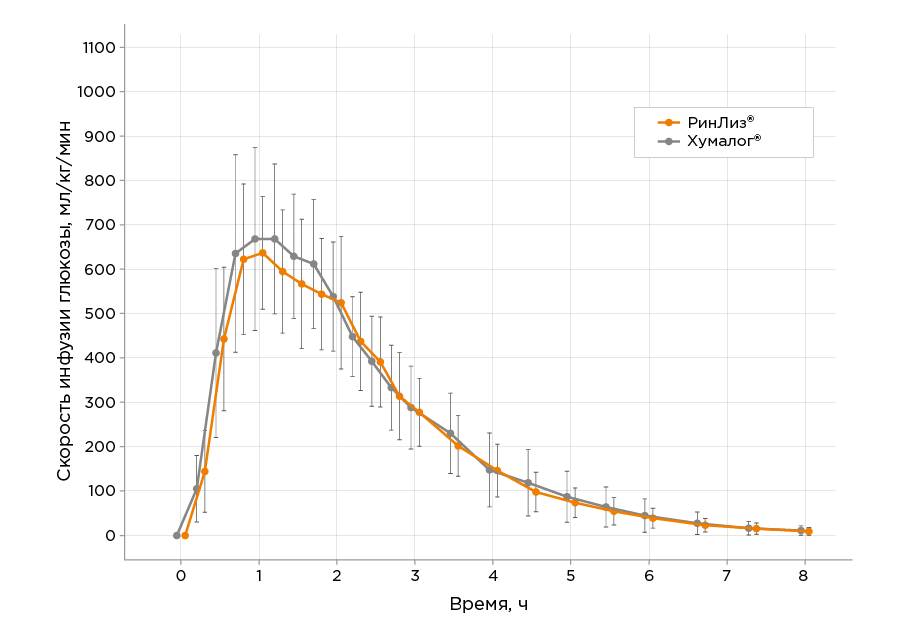
По результатам исследования оцениваемые
параметры фармакокинетики препарата РинЛиз
® и референтного препарата Хумалог®
сопоставимы.
-
11. Клинические исследования
Первоначально безопасность и эффективность референтного препарата инсулин лизпро была изучена в восьми клинических исследованиях, в которых принял участие 2951 пациент с сахарным диабетом I и II типов. В исследованиях инсулин лизпро сравнивался с растворимым инсулином человека на фоне терапии базальными инсулинами. Также были проведены исследования с участием 542 пациентов в возрасте 2-19 лет.
ГЕРОФАРМ проводил исследования безопасности и эффективности препарата РинЛиз® в сравнении с референтным препаратом, чтобы доказать сопоставимость профилей препаратов. Подробное описание таких исследований приведено ниже.
Исследования РинЛиз®
Действующее вещество препарата РинЛиз® и РинЛиз® Микс 25 представляют собой идентичную фармацевтическую субстанцию. Оценка безопасности и эффективности действующего вещества обоих препаратов выполнена в клиническом исследовании препарата РинЛиз® Микс 25, как потенциально наиболее иммуногенного в линейке препаратов инсулин лизпро. Наибольшая потенциальная иммуногенность связана с присутствием в препарате РинЛиз® Микс 25 белка протамина.
Многоцентровое рандомизированное клиническое исследование иммуногенности, эффективности и безопасности препарата РинЛиз® Микс 25 выполнено с участием пациентов с сахарным диабетом II типа (NCT04023344). Средний возраст пациентов исследования составил 57 лет, при этом, в исследовании принимали участие люди в возрасте от 37 до 65 лет, а длительность диабета в среднем достигала 10 лет. 76% пациентов получали терапию инсулином до включения в исследование. Среди участников исследования 67% были женщинами, 33 % мужчинами, средний ИМТ составил 31 кг/м2. Средний уровень HbA1c до начала лечения составил 9,4 %. Длительность терапии препаратом РинЛиз® Микс 25 составила 30 недель, 4 недели из которых занял период титрации.
В среднем, в течение исследования уровень гликированного гемоглобина снизился на 1,6%. Разница средних динамики гликированного гемоглобина составила 0,01%. При лечении препаратом РинЛиз® Микс 25 около четверти пациентов достигли уровня HbA1c≤ 7 %.



По результатам исследования по параметрам эффективности препарат РинЛиз® Микс 25 и референтный препарат инсулина лизпро двухфазный сопоставимы.
Действующим веществом в препаратах РинЛиз® и РинЛиз® Микс 25 является инсулин лизпро, который оказывает гипогликемический эффект. В препарате РинЛиз® Микс 25 содержится то же количество действующего вещества инсулина лизпро, что и в референтном препарате инсулин двухфазный 25. Таким образом, сопоставимая эффективность препарата РинЛиз® Микс 25 и референтного препарата инсулин двухфазный 25 подтверждает сопоставимость их действующих веществ – инсулина лизпро. Кроме того, эквивалентность гипогликемического действия препарата РинЛиз® по сравнению с референтным препаратом инсулина лизпро подтверждена в ходе перекрестного эугликемического клэмпа-исследовании, которое обладает наиболее высокой информативностью для оценки эффективности препаратов инсулина.
Эффективность инсулин лизпро у пациентов с сахарным диабетом I типа (данные исследований референтного препарата Хумалог® в сравнении с генно-инженерным инсулином человека, результаты актуальны для препарата РинЛиз® на основании научного принципа экстраполяции* (перенос данных).
При сравнении эффективности референтного препарата инсулин лизпро с генно-инженерным инсулином человека в 22 исследованиях, в которых принял участие 6021 пациент с сахарным диабетом I типа, было показано, что референтный препарат инсулин лизпро обладает схожей с инсулином человека гликемической эффективностью, разница средних для динамики HbA1c составила –0,09%; 95% ДИ:[ –0,16%;–0,02%]. При лечении препаратом инсулин лизпро ниже риск возникновения тяжелых гипогликемий (ОР: 0,80; 95% ДИ: [0,67; 0,96]) и ниже риск ночных гипогликемий (РР: 0,51; 95% ДИ: [0,42; 0,62) по сравнению с генно-инженерным инсулином.
Пациенты отдавали большее предпочтение референтному препарату инсулин лизпро из-за большей гибкости применения перед приемами пищи. В исследованиях с оценкой качества жизни удовлетворенность пациентов лечением была выше среди участников, получающих инсулин лизпро.
Эффективность инсулин лизпро у пациентов с сахарным диабетом II типа (данные исследований оригинального препарата Хумалог® в сравнении с генно-инженерным инсулином человека, результаты актуальны для препарата РинЛиз® на основании научного принципа экстраполяции* (перенос данных).
При сравнении эффективности референтного препарата инсулин лизпро с генно-инженерным инсулином человека в 11 исследованиях с участием 3093 пациентов с сахарным диабетом II типа, было показано, что значимая разница гликемической эффективности между препаратами отсутствует. Разница средних для динамики HbA1c составила –0,03%; 95% ДИ: [–0,12%; 0,06%]. Значимая разница между препаратами по риску возникновения тяжелых гипогликемий (РР: 0,43; 95% ДИ: [0,08; 2.37]) и ночных гипогликемий (РР: 1,63; 95% ДИ: [0,71; 3,73]) у пациентов с сахарным диабетом II типа отсутствует.
Применение у детей и подростков (данные исследований оригинального препарата Хумалог® в сравнении с генно-инженерным инсулином человека, результаты актуальны для препарата РинЛиз® на основании научного принципа экстраполяции* (перенос данных).
Оценка эффективности и безопасности применения референтного препарата инсулин лизпро у пациентов в возрасте от 9 до 18 лет выполнена в многоцентровом открытом клиническом исследовании с перекрестным дизайном. В исследование рандомизировали 463 пациента (228 пациентов в группу инсулин лизпро; 235 пациентов в группу генно-инженерного инсулина человека), исследование завершили 457 участников, средний возраст участника составил 14,9 лет. Инсулин лизпро вводили непосредственно перед приемом пищи, а генно-инженерный инсулин за 30-45 мин до еды. Исследуемые препараты пациенты получали в составе базис-болюсной терапии с НПХ-генно-инженерным инсулином человека 1-3 раза/день. Длительность терапии исследуемыми препаратами составила 8 месяцев, каждый период исследования длился 4 месяца. Результаты исследования представлены в таблице. Группы лечения были сопоставимы по уровню гликированного гемоглобина, уровню глюкозы крови натощак и частоте гипогликемий.
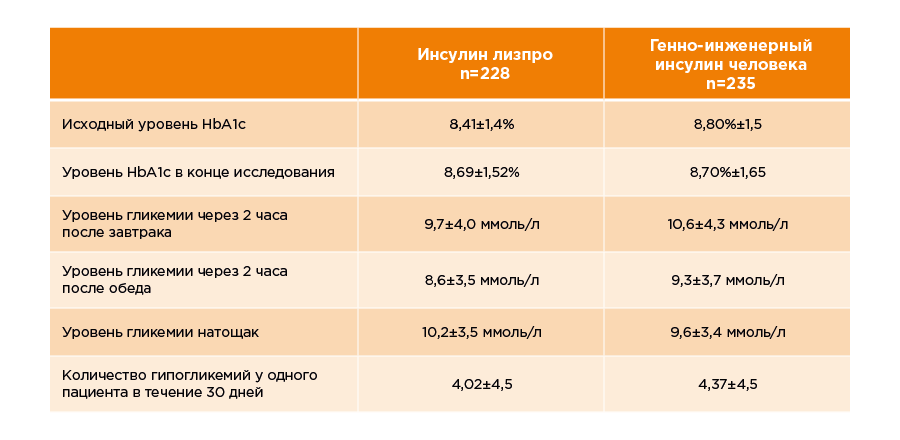
Внутривенное введение препарата инсулин лизпро (данные исследований референтного препарата Хумалог® в сравнении с генно-инженерным инсулином человека, результаты актуальны для препарата РинЛиз® на основании научного принципа экстраполяции* (перенос данных).
Сравнение безопасности и эффективности референтного препарата инсулин лизпро и генно-инженерного инсулина при внутривенном введении выполнили с участием 21 пациента с сахарным диабетом I типа. Средний возраст пациента составил 36±12 лет, средний ИМТ – 23,0±2,5 кг/м2. Пациентам в течение 6 часов вводили либо референтный препарат инсулин лизпро, либо генно-инженерный инсулин, а затем наоборот. Средний уровень гликемии в первые два часа при инфузии препарата инсулин лизпро составил 6,5±0,28 ммоль/л, при инфузии препарата генно-инженерного инсулина человека – 7,2±0,27 ммоль/л. В конце шестичасовой инфузии уровень гликемии значимо не различался между препаратами: 6,5±0,29 ммоль/л при инфузии референтного препарата инсулин лизпро, 7,0±0,29 ммоль/л при инфузии генно-инженерного инсулина человека.
*Экстраполяция — это устоявшийся научный принцип, который применяется в фармацевтике и предполагает перенос результатов исследований на другие показания применения препарата или группы пациентов на основании проведенных исследований сопоставимости.
-
12. Условия хранения
Препарат до начала использования следует хранить в холодильнике при температуре от 2 °C до 8 °C, препарат после начала использования следует хранить при комнатной температуре (не выше 30 °C) в защищенном от света или перегревания месте.
Не замораживайте препарат РинЛиз® и не используйте ранее замороженный препарат.
Не используйте препарат РинЛиз®, если раствор мутный, густой, имеет окрашивание или содержит твердые частицы.
Шприц-ручку не следует хранить с прикрепленной иглой.

-
13. Информация для консультации пациентов
Не следует передавать шприц-ручку для использования другим людьми.
Следует сообщить пациенту, что совместное использование шприц-ручки даже при смене иглы может привести к передаче различных инфекционных заболеваний.
Гипергликемия и гипогликемия
Пациента следует уведомить о том, что гипогликемия является наиболее частой нежелательной реакцией при использовании инсулина. Следует сообщить пациенту, как проявляются симптомы гипогликемии. Следует объяснить пациенту, что при возникновении гипогликемии может снижаться способность к концентрации внимания и быстрота реакции, это может быть опасно при вождении автомобиля или работе со сложными механизмами.
Также пациенту следует сообщить, что изменение режима инсулинотерапии может приводить к гипер- или гипогликемиям, изменение режима инсулинотерапии следует выполнять под контролем лечащего врача.
Ошибочное введение
Следует рассказать пациенту о необходимости проверки названия препарата перед каждым его использованием.
Введение
РинЛиз® следует вводить только в том случае, если раствор выглядит как вода (прозрачный, бесцветный раствор). Следует проверять препарат перед каждым введением.
Действия пациента в особых ситуациях
Пациенты должны быть обучены методам самостоятельного мониторинга глюкозы, технике инъекций инсулина, способам купирования гипогликемий и гипергликемий. Пациенты должны знать о мерах, которые они должны предпринять в случае развития сопутствующий заболеваний или стресса, в случае пропуска инъекции или введения неадекватной дозы, в случае пропуска приема пищи или неадекватного приема пищи.
-
14. Информация для пациентов
















