РинГлар®
Данный раздел объясняет, на каком основании препарат РинГлар® был зарегистрирован на территории Российской Федерации, а также содержит подробное описание показаний к применению и особенностей применения препарата. При этом, раздел не имеет цели дать какие-либо практические рекомендации по использованию препарата. Для получения рекомендаций по использованию препарата РинГлар® пациентам стоит обратиться к лечащему врачу.
- 1. Что такое РинГлар® и для чего он применяется?
РинГлар® – это лекарственный препарат, действующим веществом которого является инсулин гларгин. Он используется для терапии сахарного диабета у взрослых и детей старше двух лет.
Ринглар® является биосимиляром. Это означает, что РинГлар® обладает высокой степенью сходства с биологическим препаратом (так называемым референтным препаратом), который уже зарегистрирован на территории Российской Федерации. Референтны препарат для РинГлар® – Лантус® Солостар®.
- 2. Как используется РинГлар®?
РинГлар® доступен в предзаполненных шприц-ручках (РинАстра® II) и может применяться исключительно по назначению врача.Вводится подкожно в область живота, ягодиц, бедер или плеча. Необходимо использовать разные места для инъекций, чтобы уменьшить риск развития липодистрофий и, как следствие, ухудшение эффективности вводимого инсулина. РинГлар® вводится один раз в день в одно и то же время. Доза подбирается индивидуально. Необходимо измерять уровень глюкозы в крови пациента, чтобы подобрать самую низкую эффективную дозу. РинГлар® может комбинироваться с преоральными сахароснижающими препаратами, которые используются для терапии сахарного диабета 2 типа. С более подробной информацией о препарате можно ознакомиться в инструкции по медицинскому применению, которая размещена на сайте и вложена в каждую упаковку препарата. - 3. Как работает РинГлар®?
Высокий уровень глюкозы в крови пациентов с диагнозом сахарный диабет связан с тем, что организм либо не вырабатывает достаточное количество инсулина, либо вырабатываемого инсулина недостаточно, чтобы покрыть потребность в нем. РинГлар® – это замена инсулина, естественно вырабатываемого организмом человека, очень близкая к нему по оказываемому действию. Такой замещающий инсулин действует так же, как и естественный инсулин, и помогает глюкозе проникать в клетки крови. Контроль уровня глюкозы в крови позволяет снизить риск осложнений диабета. Активное вещество препарата РинГлар®, инсулин гларгин, получают, используя технологию рекомбинантной ДНК. Это означает, что в продуцирующие белок клетки вставляют кольцевую ДНК – она содержит искусственный ген, необходимый для синтеза молекулы инсулина гларгин. Инсулин гларгин неcколько отличается от человеческого инсулина. Данное отличие заключается в том, что его действие развивается более медленно и равномерно после инъекции и имеет большую продолжительность действия. - 4. Какие результаты показали исследования РинГлар®?
Все проведенные исследования выявили высокую степень схожести РинГлар® референтному Лантус® Солостар®: были получены высокой степени схожести данные в in vitro фармакодинамических исследованиях, были доказаны эквивалентная биодоступность в гиперинсулинемических эугликемических клэмпах и сопоставимая иммуногенность. Доказаны схожая эффективность и безопасность препаратов: гликированный гемоглобин, концентрация глюкозы натощак, суточные профили гликемии препаратов совпадают. Количество гипогликемий и реакций в местах инъекций при использовании РинГлар® не превышает таковое для Лантус® Солостар®. - 5. Какие нежелательные реакции вызывает РинГлар®?
Наиболее распространенным побочным эффектом РинГлар® (может встречаться чаще чем у 1 из 10 человек) является гипогликемия (низкий уровень глюкозы в крови). Реакции в месте инъекции (покраснение, боль, зуд и отек) и кожные реакции (сыпь) чаще встречаются у детей, чем у взрослых. Полный список всех нежелательных реакций и показаний к применению с осторожностью РинГлар®. С полным списком нежелательных реакций можно ознакомиться в инструкции по медицинскому применению препарата (вкладыш в упаковку). - 6. На каком основании было выдано регистрационное исследование на препарат РинГлар®?
Министерство здравоохранения Российской Федерации на основании требований, которые предъявляются к биотехнологическим препаратам на национальном уровне, признало, что РинГлар® обладает высокой степенью сходства с референтным препаратом Лантус® Солостар® по составу молекулы и готовой лекарственной формы, степени очистки и биологической активности и попадает в организм аналогичным путем. Кроме того, как показывают исследования, оба препарата обладают одинаковыми эффективностью в снижении уровня глюкозы в крови и нежелательными реакциями. С общим подходом ГЕРОФАРМ к исследованиям можно ознакомиться здесь. Таким образом, Министерство здравоохранения Российской Федерации признало, что, так же, как и для препарата Лантсус Солостар®, польза достоверно превышает риск использования РинГлар®. На основание вышеперечисленного было выдано соответствующее регистрационное удостоверение. - 7. Какие действия были предприняты, чтобы обеспечить эффективное и безопасное применение
препарата РинГлар®?
Перед регистрацией препарата был разработан план управления рисками. Рекомендации и противопоказания, которые следует учитывать работникам сферы здравоохранения и пациентам, чтобы использование препарата РинГлар® было эффективным и безопасным, отражены в инструкции по медицинскому применению препарата (вкладыш в упаковку). - 8. Прочая информация о препарате РинГлар®
Министерство здравоохранения Российской Федерации выдало регистрационное удостоверение на препарат РинГлар® (ЛП-005648) сроком на 5 лет 10.07.2019. Для того, чтобы получить больше информации о терапии препаратом РинГлар®, пациенту стоит обратиться к инструкции по медицинскому применению препарата и своему лечащему врачу.
Зарегистрирован 10.07.2019: регистрационное удостоверение номер ЛП-005648 сроком на 5 лет.
-
1. Показания для применения
РинГлар® показан для лечения сахарного диабета
у взрослых, подростков и детей старше 2 лет. -
2. Режим введения и дозирование
a. Важные аспекты применения:
- Необходимо всегда проверять название препарата перед введением.
- До начала применения пациент должен быть обучен технике введения препарата.
- Перед каждым введением РинГлар® необходимо выполнить визуальную оценку препарата. РинГлар® можно использовать только в том случае, если он представляет бесцветный прозрачный раствор без каких-либо твердых частиц.
- За один раз можно ввести от 1 и 80 ЕД препарата РинГлар®.
- РинГлар® необходимо вводить в область передней брюшной стенки, бедра или плеча. Необходимо постоянно менять места введения препарата, это поможет избежать развития липодистрофий.
- Не следует вводить препарат в места уже существующих липодистрофий.
- Во время изменения режима инсулинотерапии следует увеличить частоту мониторинга гликемии.
- Не следует разбавлять РинГлар® или смешивать его с другими препаратами инсулина, это может оказать непредсказуемое влияние на начало и длительность действия РинГлар®.
- Препарат РинГлар® запрещено вводить внутривенно или с помощью продолжительных подкожных инфузий.
b. Инструкции по дозированию:
- Пациентам с сахарным диабетом I типа следует использовать РинГлар® вместе с препаратами инсулина короткой и ультракороткой продолжительности действия.
- Пациенты с сахарным диабетом II типа могут применять препарат РинГлар® в качестве монотерапии или в комбинации с препаратами инсулина короткой или ультракороткой продолжительности действия, или в комбинации с другими сахароснижающими препаратами.
- РинГлар® следует вводить один раз в сутки в любое время суток, но каждый день в одно и то же время.
- Дозу препарата РинГлар® устанавливают в индивидуальном порядке в зависимости от метаболических потребностей, гликемических целей и результатов измерений уровня глюкозы в крови.
- При изменении уровня физической активности или режима питания может потребоваться коррекция дозы. Также коррекция дозы может понадобиться при острых заболеваниях, нарушении функции почек или печени. Коррекцию дозы следует выполнять под наблюдением специалиста с адекватным мониторингом гликемии.
Начало терапии препаратом РинГлар®:
- Начинать терапию препаратом РинГлар® у пациентов с сахарным диабетом I типа следует примерно с одной трети суточной потребности в препаратах инсулина. Оставшаяся часть суточной потребности в препаратах инсулина должна быть введена в виде инсулинов короткой, ультракороткой продолжительности действия.
- Начинать терапию препаратом РинГлар® у пациентов с сахарным диабетом II типа следует с 0,2 ЕД/кг или до 10 ЕД один раз в день. Может потребоваться коррекция дозы и времени введения препаратов инсулина ультракороткой и короткой продолжительности действия, а также любых других противодиабетических препаратов.
Переход на РинГлар® с других препаратов инсулина:
- При переходе с одного препарата инсулин гларгин, раствор 100 ЕД/мл, на препарат РинГлар®, раствор 100 ЕД/мл, следует использовать те же дозу препарата и время введения, которые были определены специалистом.
- При переходе с препарата инсулин гларгин, раствор 300 ЕД/мл, на препарат РинГлар®, раствор 100 ЕД/мл, начальная доза препарата РинГлар® должна составить 80 % от дозы препарата инсулин гларгин, раствор 300 ЕД/мл на момент перехода.
- При переходе с других препаратов инсулина длительного действия (за исключением препарата инсулин гларгин, раствор 100 ЕД/мл) на препарат РинГлар® может потребоваться коррекция дозы и времени введения базального инсулина, также может потребоваться изменение режима введения других препаратов инсулина короткой продолжительности действия или любых других противодиабетических препаратов.
- При переходе с препарата НПХ-инсулина при его введении два раза в день на РинГлар® один раз в день рекомендуется использовать 80 % дозы от дозы суточной дозы НПХ-инсулина на момент перехода.
В первые недели после изменения режима инсулинотерапии сокращение дозы инсулина следует компенсировать, хотя бы частично, увеличением дозы прандиального инсулина (корректирующего гипергликемию после приема пищи), затем курс лечения следует скорректировать в индивидуальном порядке.
В момент изменения режима инсулинотерапии, а также в течение нескольких последующих недель рекомендуется осуществлять тщательный метаболический контроль (контроль гликемии).
-
3. Доступные лекарственные формы
РинГлар®, раствор для подкожного введения 100 ЕД/мл. -
4. Противопоказания
РинГлар® противопоказан: - Во время текущего эпизода гипогликемии.
- Пациентам с гиперчувствительностью к препарату инсулин гларгин и его компонентам.
-
5. Меры предосторожности
- Не следует совместно с кем-либо использовать шприц-ручку с препаратом РинГлар®.
Совместное применение препарата РинГлар® значительно увеличивает риск передачи инфекций (например, гепатит B, С, ВИЧ и другие).
- Гипергликемия и гипогликемия при изменении режима инсулинотерапии.
Изменение режима инсулинотерапии может оказывать влияние на гликемический контроль и предрасположенность к гипогликемии. Повторные инъекции в места липодистрофий могут приводить к гипергликемии, а внезапная смена места инъекции (на участок, в который ранее не вводили препарат) может приводить гипогликемии.
Внесение любых изменений в режим инсулинотерапии должно осуществляться под наблюдением специалиста в условиях адекватного мониторинга уровня гликемии. Пациенты, которые постоянно вводят препараты инсулина в зоны липодистрофии, должны быть проинструктированы о необходимости смены зон инъекций и возможных гипогликемиях при переходе. У пациентов с сахарным диабетом II типа может потребоваться коррекция дозы других противодиабетических препаратов.
Известны случаи ошибочного применения вместо препарата инсулин гларгин, 100 ЕД/мл, других препаратов инсулина, в частности, аналогов инсулина ультракороткой продолжительности действия. Избежать таких ошибок можно при проверке маркировки препарата перед каждым его введением.
-
6. Нежелательные реакции
Нежелательные реакции, которые могут возникнуть при использовании препарата РинГлар®, не отличаются от таковых при использовании любого другого препарата инсулина и обусловлены действием инсулина и белковой природой молекулы.
6.1. ГипогликемияГипогликемия – самая частая нежелательная реакция при инсулинотерапии, включая терапию препаратом РинГлар®. Тяжелая гипогликемия может быть причиной жизнеугрожающих состояний и смерти. Гипогликемия может приводить к снижению концентрации внимания и замедлению реакции, это может подвергнуть опасности как самого человека, получающего препарат, так и окружающих его людей (например, при вождении транспортных средств и работе со сложными механизмами). РинГлар®, как и любой другой препарат инсулина, не следует применять во время эпизода гипогликемии.
Гипогликемическое состояние может возникнуть внезапно, симптомы гипогликемии могут отличаться у разных людей или могут меняться с течением времени у одного и того же человека. Симптомы гипогликемии могут быть менее выражены у пациентов с длительно существующим сахарным диабетом, у пациентов с диабетической нейропатией или при применении некоторых лекарственных препаратов (раздел 7).
Факторы риска развития гипогликемии:
Риск развития гипогликемии после выполнения инъекции препарата инсулина связан с профилем действия препарата и, как правило, выше при достижении его максимальной гипогликемической активности. У препарата РинГлар®, как и у других препаратов инсулина, профиль активности может отличаться у разных людей или у одного и того же пациента в разное время. Профиль активности зависит от многих факторов, включая место инъекции, степень его кровоснабжения и температуру. Риск гипогликемии возрастает с увеличением интенсивности гликемического контроля. Изменение режима питания (содержание макронутриентов, время приема пищи) и физической активности также может приводить к развитию гипогликемий. Кроме того, любые изменения в применении других лекарственных препаратов (прием новых препаратов, изменение дозы или частоты применения ранее используемых лекарственных средств) могут способствовать развитию гипогликемий. Лекарственные препараты, которые могут оказывать потенциальное влияние на развитие гипогликемий, представлены в разделе (раздел 7).
Пути снижения риска возникновения гипогликемии
Пациенты и лица, осуществляющие уход за пациентами, должны уметь распознавать симптомы гипогликемии. Самоконтроль гликемии является одним из ключевых способов профилактики и контроля гипогликемии. Пациентам с высоким риском развития гипогликемий или пациентам со сниженной чувствительностью к симптомам гипогликемии следует более часто измерять уровень глюкозы крови.
Препарат РинГлар® обладает длительным действием, что может увеличивать продолжительность эпизодов гипогликемии.
6.2. Гиперчувствительность и аллергические реакцииГиперчувствительность и аллергические реакции при лечении препаратом РинГлар® возникают редко (≥1/10000, но <1/1000). Тяжелые жизнеугрожающие случаи генерализованной аллергии, в частотности анафилактический шок, могут возникать при применении любых препаратов инсулина, в том числе препарата РинГлар®. Если при применении препарата РинГлар® возникают аллергические реакции, необходимо прекратить его введение. Лечение аллергических реакций рекомендуется проводить с учетом актуальных стандартов лечения. РинГлар® противопоказан пациентам с гиперчувствительностью к любым другим препаратам инсулин гларгин или его вспомогательным веществам. Перечень вспомогательных веществ представлен в разделе (раздел 10).
6.3. ГипокалиемияВсе препараты инсулина, в частности РинГлар®, способствуют переходу ионов калия из внеклеточного пространства во внутриклеточное, что может приводить к развитию гипокалиемии. При отсутствии лечения гипокалиемия может быть причиной развития паралича дыхательных мышц, желудочковых нарушений ритма сердца и смерти. Рекомендуется осуществлять мониторинг уровня калия у пациентов с риском развития гипокалиемии (пациенты, применяющие препараты, снижающие уровень калия в крови, или препараты, связывающие ионы калия).
6.4. Задержка жидкости и сердечная недостаточность при одновременном применении
с тиазолидиндионами.Тиазолидиндионы относятся к классу агонистов рецепторов, активирующих пролиферацию пероксисом-гамма (PPAR-γ). Препараты данной группы могут приводить к задержке жидкости в организме, особенно при сочетании с препаратами инсулина. Задержка жидкости может потенциально приводить к развитию или прогрессированию сердечной недостаточности. Пациентам, получающим одновременно РинГлар® и тиазолидиндионы, рекомендуется наблюдение для выявления симптомов сердечной недостаточности. При развитии сердечной недостаточности рекомендуется рассмотреть вопрос отмены тиазолидиндионов или снижения их дозы. Для лечения сердечной недостаточности рекомендуется использовать актуальные стандарты по оказанию медицинской помощи.
6.5. Опыт клинических исследованийКлинические исследования проводятся с участием разных популяций пациентов в разных условиях, поэтому частота нежелательных реакций в разных клинических исследованиях и в реальной клинической практикой может несколько отличаться.
Данные клинических исследования, проведенных ГЕРОФАРМ
Для изучения безопасности лекарственного препарата РинГлар® были проведены 2 клинических исследования с участием пациентов с сахарным диабетом I типа:
Перекрестное исследование фармакокинетики и фармакодинамики, в котором приняли участие пациенты с сахарным диабетом I типа. Идентификационный номер исследования в системе ClinicalTrials.gov – NCT04101383. Данное исследование проводилось для оценки параметров фармакокинетики и фармакодинамики (раздел 11), однако в нем также оценивались и параметры безопасности применения препарата РинГлар®.
В исследовании приняли участие 49 пациентов, из которых 42 участника были рандомизированы. Средний возраст участника составил 31±8.56 лет, средний ИМТ – 24,5 кг/м2. При включении в исследование средний уровень HbA1c составил 7,26 %, уровень С-пептида – 0,1 нг/мл. Все участники исследования получили препарат РинГлар® и референтный препарат инсулин гларгин в дозе 0,6 ME/кг, в момент проведения исследования другие препараты инсулина пациенты не получали. Данные о нежелательных реакциях в исследовании представлены в таблице 1. Нежелательные реакции – это нежелательные явления, возникновение которых имеет потенциальную связь с исследуемым препаратом.

Возникшие нежелательные реакции разрешились в течение исследования и не отразились на клиническом состоянии пациентов.
Многоцентровое рандомизированное клиническое исследование иммуногенности, безопасности и эффективности препарата РинГлар®, в котором приняли участие пациенты с сахарным диабетом I типа. Идентификационный номер исследования в системе ClinicalTrials.gov – NCT04022993.
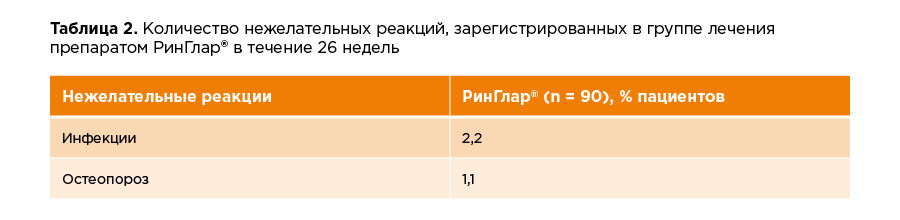
В исследование скринировали 194 участника, из которых рандомизировали 180 пациентов с сахарным диабетом I типа. Средний возраст участников составил 38,5 ±10.84 лет, средний ИМТ – 24,3 кг/м2. 53 % участников были мужского пола, 47 % – женского. Средняя продолжительность сахарного диабета I типа на момент включения в исследование составила 14 лет. Все пациенты до включения в данное исследование получали препараты инсулина в режиме базис-болюсной терапии. Средняя суточная доза препарата РинГлар® на момент окончания исследования составила 23,33 МЕ. Длительность применения препарата РинГлар® составила 26 недель. Болюсный инсулин пациенты вводили в соответствии с индивидуальной метаболической потребностью. Данные о нежелательных реакциях в исследовании представлены в таблице 2.
Гипогликемии относятся к наиболее частым
нежелательным реакциям инсулинотерапии и связаны с механизмом действия
препарата. В настоящем исследовании эпизоды гипогликемии анализировали отдельно
как нежелательные реакции особого интереса. Данные по эпизодам гипогликемии представлены
в таблице 3.
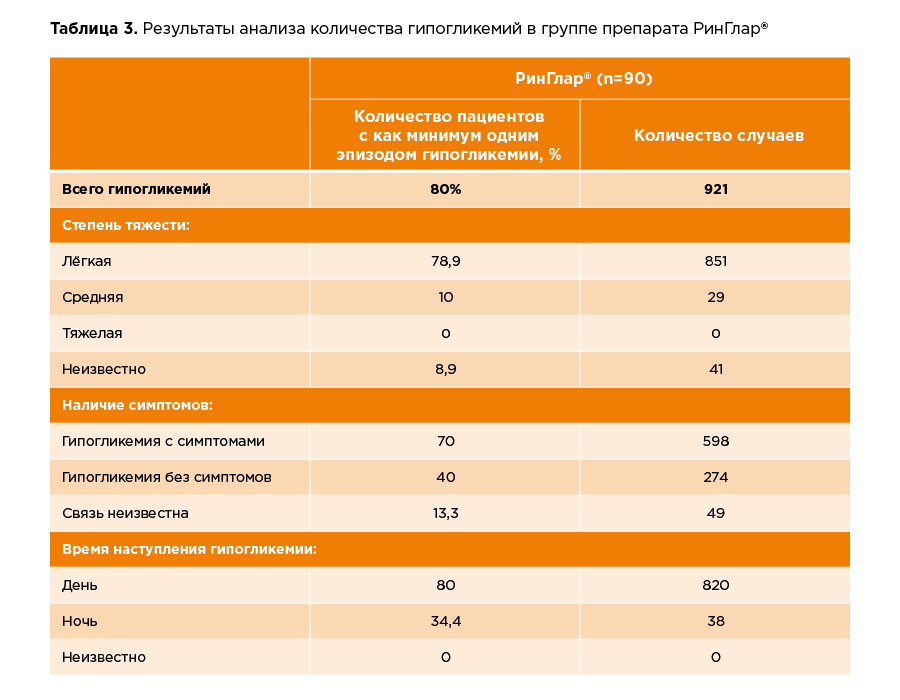
Большая часть эпизодов гипогликемии были легкой степени тяжести и возникали, как правило, в дневное время. 80 % эпизодов гипогликемии сопровождались симптомами.
Реакции в месте введения препарата РинГлар® зарегистрировали у 2 пациентов (2,2 %).
Иммуногенность препарата РинГлар® в клинических исследованиях
Иммуногенность препарата РинГлар® также оценивали в исследовании NCT04022993. У 4 пациентов (4,4 %) в группе препарата РинГлар® зарегистрировали диагностически значимое количество антител к инсулину до начала исследования. На момент окончания исследования у 2 пациентов (2,2 %) зарегистрирован иммунный ответ (диагностически значимая концентрация АТ к инсулину или ее увеличение на 30 %). В течение исследования в группе препарата РинГлар® отмечалось незначительное снижение концентрации антител к инсулину. По результатам анализа концентрация антител к инсулину не влияла на эффективность лечения (уровень HbA1c и доза инсулина).
На сегодняшний день в рамках клинических исследований накоплен большой опыт применения референтного препарата инсулин гларгин, 100 ЕД/мл. В таблице ниже представлены наиболее частые нежелательные реакции, возникшие в ходе 5-летнего исследования референтного препарата инсулин гларгин у пациентов с сахарным диабетом II типа. 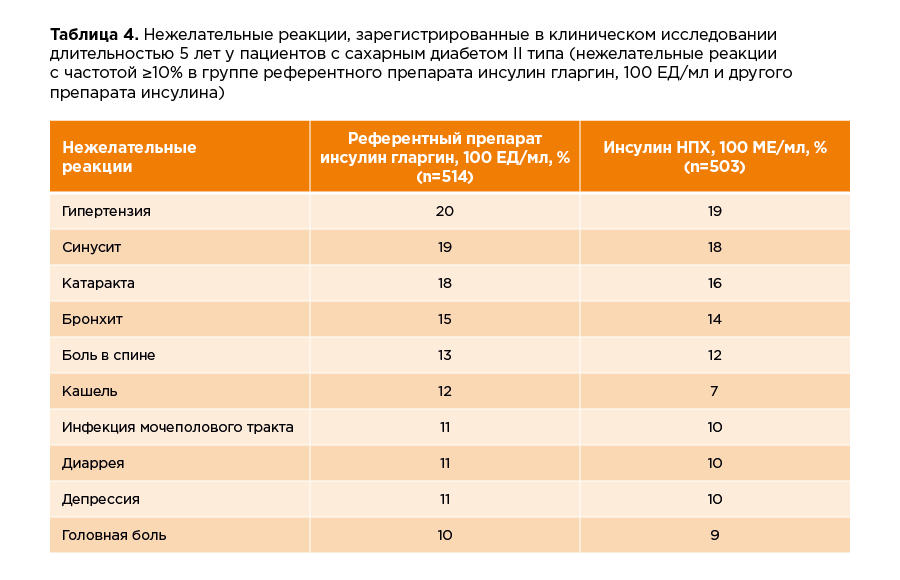
Для референтного препарата инсулин гларгин, 100 ЕД/мл, также есть данные клинических исследований о безопасности его безопасности у детей и подростков.

-
7. Лекарственные взаимодействия
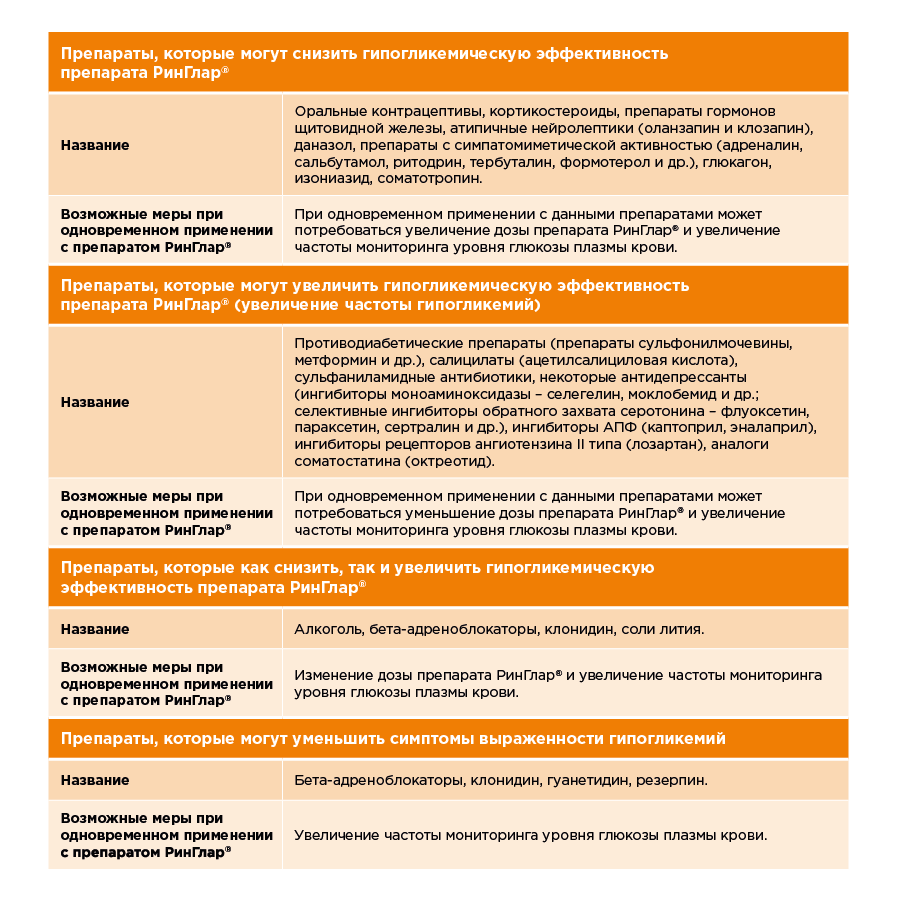
Некоторые лекарственные препараты при
одновременном применении с препаратом РинГлар® могут влиять на его
гипогликемическую эффективность.
-
8. Применение в особых популяциях пациентов
Особые популяции рассматриваются отдельно от остальной популяции, так как абсорбция, распределение, метаболизм и выведение лекарственных препаратов могут отличаться у некоторых групп людей. Например, у пациентов с хронической болезнью почек, ожидается замедленное выведение препарата. Изучение действия препарата инсулин гларгин в особых популяциях выполнено в клинических исследованиях референтного препарата инсулин гларгин, 100 ME/мл. В соответствии с Решением ЕАЭК №89 от 03.11.2019 г. и директивой Европейского Медицинского Агентства 2015 EMEA/CHMP/BMWP/32775/2005_Rev. 1 биосимиляр может применяться во всех популяциях, зарегистрированных для референтного препарата. Ниже приведены данные исследований референтного препарата Лантус® Солостар® на особых популяциях пациентов, которые были экстраполированы (перенесены) на РинГлар® на основании доказанной высокой степени сходства молекулы, готовой лекарственной формы, эффективности и безопасности препарата. Беременные женщины Опубликованные исследования применения референтного препарата инсулин гларгин, 100 ME/мл, во время беременности не установили связи между применением препарата и неблагоприятными последствиями развития беременности. Риски для матери и плода ассоциированы с плохо контролируемым во время беременности сахарным диабетом. В доклиническом исследовании референтного препарата инсулин гларгин на кроликах и крысах было показано, что препарат не оказывает влияния на органогенез в дозах, превышающих эквивалентную для человека дозу 0,2 EД/кг/день, в 50 и 10 раз соответственно. В целом, эффекты референтного препарата инсулин гларгин у кроликов и мышей не отличаются от таковых у генно-инженерного инсулина человека. Контроль гликемии на протяжении всего периода беременности крайне важен для состояния здоровья ребенка. Плохой гликемический контроль во время беременности может негативно сказываться на ее течении и развитии плода. Расчетный риск возникновения врожденных пороков развития у женщин с сахарным диабетом, установленным до наступления беременности, при уровне HbA1c >7 % составляет 6-10 %, при уровне HbA1c >10 % риск возрастает до 20-25 %. Частота самопроизвольных абортов у женщин с сахарным диабетом неизвестна. В популяции в целом частота врожденных пороков развития составляет 2-4 %, частота самопроизвольных абортов составляет 15-20 %. Кормящие женщины Данные о наличии референтного препарата инсулин гларгин в грудном молоке, влиянии на ребенка на грудном вскармливании или влиянии на выработку молока отсутствуют. Эндогенный инсулин присутствует в грудном молоке. Следует учитывать преимущества грудного вскармливания для развития и здоровья ребенка, а также клиническую потребность матери в препарате РинГлар® и любые потенциальные неблагоприятные последствия для ребенка на грудном вскармливании или состояния здоровья матери. Дети Безопасность и эффективность применения референтного препарата инсулин гларгин, 100 ЕД/мл, установлена в клинических исследованиях с участием детей с сахарным диабетом I типа в возрасте старше двух лет (раздел 12). Безопасность и эффективность применения референтного препарата инсулин гларгин, 100 ЕД/мл, у детей младше двух лет и у детей с сахарным диабетом II типа не исследовалась. Рекомендации при переходе на препарат РинГлар® у детей старше двух лет такие же, как и у взрослых пациентов (раздел 2.2). Как и у взрослых, доза препарата РинГлар® у детей с сахарным диабетом I типа устанавливается специалистом в индивидуальном порядке в соответствии с метаболическими потребностями. Пожилые пациенты В клинических исследованиях референтного препарата инсулин гларгин, 100 ЕД/мл, у пациентов с сахарным диабетом II типа приняли участие 28,3 % пациентов 65 лет и старше, при этом 4,5 % пациентов были в возрасте 75 лет и старше. Никаких различий по параметрам эффективности и безопасности между пожилыми и более молодыми пациентами не установлено. Однако не исключена большая чувствительность у некоторых пожилых пациентов. Тем не менее следует соблюдать осторожность при применении РинГлар® у пожилых пациентов. Люди старшей возрастной группы могут не замечать симптомов гипогликемии, поэтому подход к выбору стартовой дозы, увеличению дозы и поддерживающей дозе должен быть консервативен. Нарушение функции почек Фармакокинетика препарата РинГлар® и референтного препарата инсулин гларгин, 100 ЕД/мл, не изучалась у пациентов со значительными нарушениями функции почек. Некоторые исследования генно-инженерного инсулина человека установили более длительную циркуляцию в крови инсулина при нарушении функции почек. При применении препарата РинГлар® у пациентов с нарушением функции почек рекомендуется более частый мониторинг глюкозы крови и, при необходимости, изменение дозы препарата. Нарушение функции печени Фармакокинетика препарата РинГлар® и референтного препарата инсулин гларгин, 100 ЕД/мл, не изучалась у пациентов со значительными нарушениями функции печени. Более частый мониторинг глюкозы и коррекция дозы могут быть необходимы при применении препаратов инсулина, включая препарат РинГлар®, у пациентов с нарушениями функции печени. -
9. Передозировка
Для препаратов инсулина строго не определена доза, которая может быть использована для регистрации передозировки. Передозировку следует рассматривать как избыточное введение препарата инсулина относительно количества потребленной пищи и расхода энергии. Последствием избыточного введения препарата может быть развитие гипогликемии и гипокалиемии. Легкие эпизоды гипогликемии могут быть купированы пероральным приемом глюкозы или пищи с высоким содержанием глюкозы. Передозировка (превышение количества введенного инсулина над потребностью в инсулине) может потребовать коррекции дозы, режима питания или физической активности. Более тяжелые эпизоды гипогликемии, сопровождающиеся потерей сознания и неврологическими нарушениями, могут потребовать внутримышечного/подкожного введения глюкагона или внутривенного введения концентрированного раствора глюкозы. Может потребоваться длительное потребление углеводов и наблюдение, потому что гипогликемия может развиться вновь после купирования. Коррекция гипокалиемии проводится только квалифицированным медицинским персоналом с помощью введения препаратов, содержащих калий. -
10. Описание
Инсулин гларгин относится к аналогам инсулина человека длительного действия для подкожного введения. РинГлар® получают с помощью технологии рекомбинантной ДНК, используя непатогенный лабораторный штамм Escherichia coli (штамм BL21). Инсулин гларгин отличается от инсулина человека заменой аминокислоты аспарагин в положении A21 на глицин, а также наличием дополнительных двух молекул аргининов на С-конце B-цепи. Химическая формула препарата инсулин гларгин представляет собой 21A-Gly-30B-a-L-Arg-30Bb-L-Arg-инсулин человека, эмпирическая формула - C267H404N72O78S6. Молекулярная масса составляет 6063 Да. Структурная формула препарата РинГлар® представлена на рисунке: 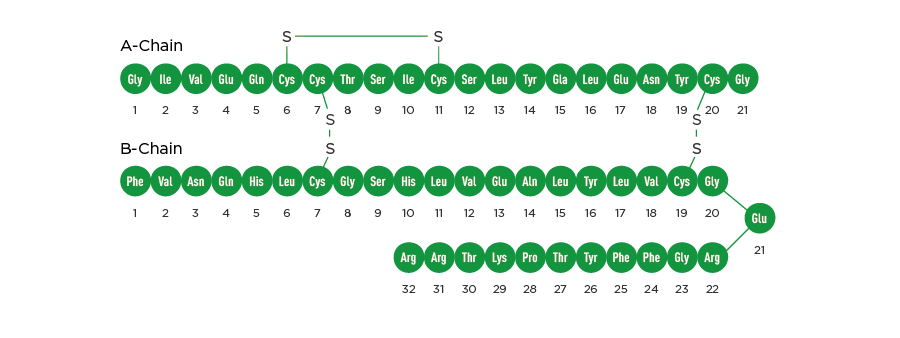
РинГлар® – прозрачная бесцветная или почти бесцветная жидкость. В 1 мл РинГлар® содержится: действующее вещество – инсулин гларгин, 100 ME (3,6378 мг); вспомогательные вещества: метакрезол, 2,7 мг; цинка хлорид, до содержания цинка Zn2+ 30 мкг/мл; глицерол, 17 мг (в пересчете на глицерол 85 % - 20 мг); хлористоводородная кислота разведенная 10 % и/или натрия гидроксида раствор 10 %, до pH 4,0; вода для инъекций, до 1 мл.
-
11. Клиническая фармакология
11.1. Механизм действияИнсулин действует через специфические рецепторы, связанные с мембраной клеток органов-мишеней. Действие препарата направлено на регуляцию метаболизма углеводов, белков и жиров. К органам-мишеням инсулина относятся печень, скелетная мышечная ткань и жировая ткань.
В печени инсулин стимулирует синтез гликогена. Инсулин также способствует синтезу жирных кислот в печени, которые секретируются в кровь в виде липопротеинов. В скелетных мышцах инсулин увеличивает синтез белка и гликогена. В жировой ткани инсулин стимулирует превращение липопротеинов в жирные кислоты и триглицериды. Кроме того, инсулин препятствует разрушению триглицеридов в жировой ткани. Инсулин стимулирует поглощение клетками аминокислот и некоторых ионов, например, ионов калия, магния и фосфатов.
В организме человека инсулин гларгин метаболизируется с образованием двух активных метаболитов M1 и M2. В исследованиях in vitro было показано, что аффинность препарата инсулин гларгин и его метаболитов к инсулиновому рецептору похожа на инсулин человека. Аффинность препарата инсулин гларгин к ИФР-1 рецептору примерно в 5-8 раз выше, чем у инсулина человека (но примерно в 70-80 раз ниже, чем непосредственно у инсулиноподобного фактора роста-1). Аффинность активных метаболитов (M1 и M2) к ИФР-1 рецептору относительно низкая и сопоставима с инсулином человека.
Фармакокинетика и фармакодинамика препарата РинЛиз® были изучены в ходе перекрестного эугликемического клэмп-исследования, проведенного ГЕРОФАРМ (см пункт 11.1 и 11.2).
11.2. ФармакодинамикаФармакодинамический профиль препарата РинГлар® определили при подкожном введении в дозе 0,6 ЕД/кг в ходе перекрестного исследования фармакокинетики и фармакодинамики (гиперинсулинемического эугликемического клэмп-исследования) – NCT04101383. В исследовании NCT04101383 приняли участие 42 пациента мужского пола с сахарным диабетом I типа. Средняя суммарная площадь под кривой «скорость инфузии глюкозы-время» в интервале от начала до дозировочного интервала (AUCGIR0-τ) составила 41,83 мг/кг×60. Средняя суммарная площадь под кривой «скорость инфузии глюкозы-время» в интервале от начала до середины дозировочного интервала (AUCGIR0- τ50%) составила 21,91 мг/кг×60, а средняя суммарная площадь под кривой «скорость инфузии глюкозы-время» в интервале от середины до окончания дозировочного интервала (AUCGIR τ50%- τ) – 8,57 мг/кг×60. Среднее время между введением препарата и началом инфузии глюкозы (tGIRlag) составило 0,75 ч. Ниже представлен график усредненных фармакодинамических кривых после подкожного введения препарат РинГлар® и референтного препарата инсулин гларгин, 100 ЕД/мл. 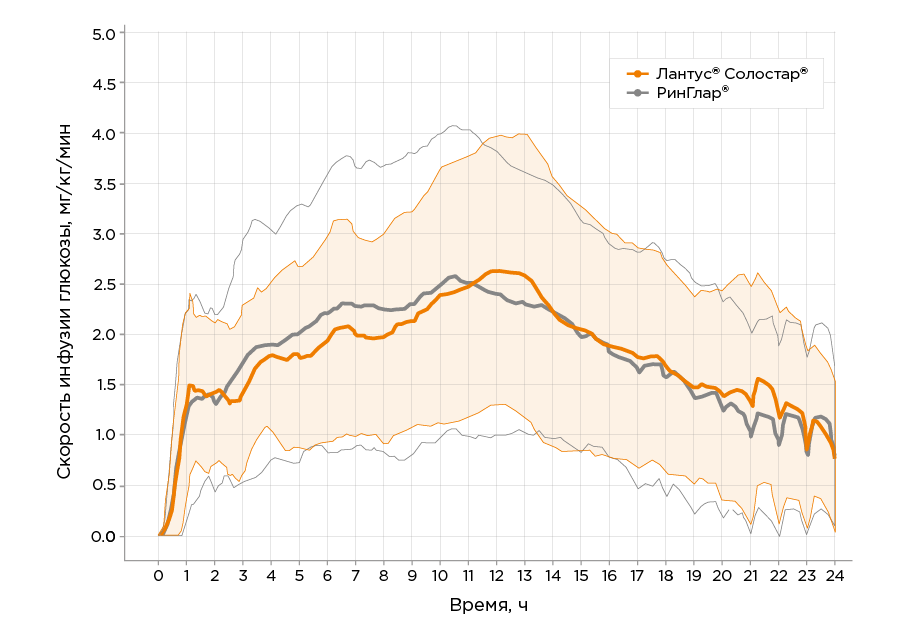
Препарат РинГлар® и референтный препарат
инсулин гларгин, 100 ЕД/мл сопоставимы по исследуемым параметрам фармакодинамики.
11.3. ФармакокинетикаФармакокинетический профиль препарата РинГлар® определен в ходе перекрестного эугликемического гиперинсулинемического клэмп-исследования с участием 42 пациентов при однократном подкожном введении препарата в дозе 0,6 ЕД/кг. Средняя суммарная площадь под кривой «концентрация исследуемого инсулина - время» в интервале времени от 0 до конца дозировочного интервала (AUCins.0-τ) составила 285,77 (мкМЕ/мл) ×ч. Средний период полувыведения (t1/2) составил 17,58 ч. Ниже представлены усреднённые фармакокинетические профили концентрации инсулина гларгин в плазме крови участников после подкожного введения препарата РинГлар® и референтного препарата инсулин гларгин, 100 ЕД/мл, в полулогарифмических координатах. 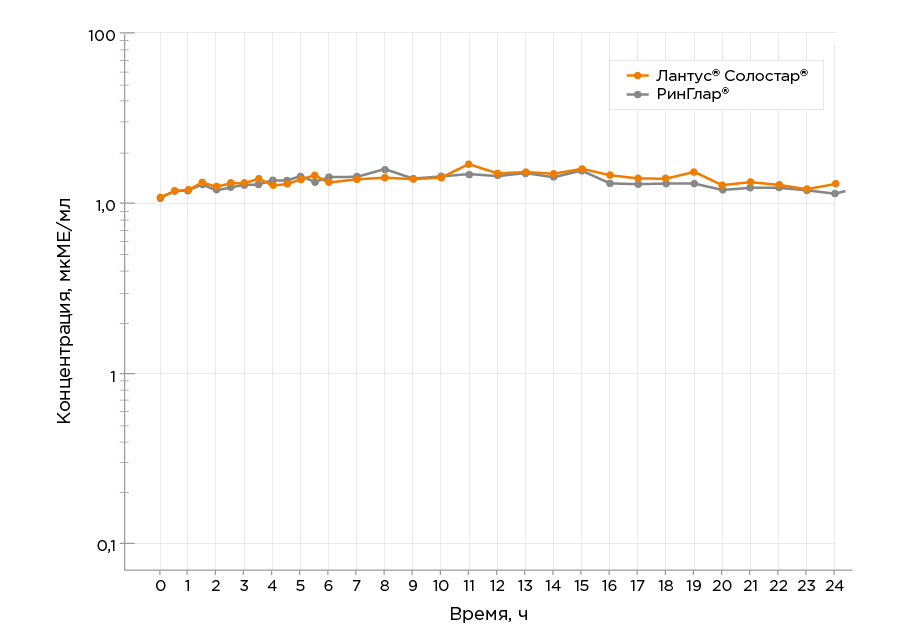
Препарат РинГлар® и референтный препарат
инсулин гларгин, 100 ЕД/мл сопоставимы по исследуемым параметрам
фармакокинетики.
-
12. Клинические исследования
Безопасность и эффективность референтного препарата инсулин гларгин, 100 ЕД/мл, были подтверждены в ходе трех клинических исследований с участием взрослых пациентов с сахарным диабетом I типа (общее количество участников составило 1738 пациентов), трех клинических исследований с участием детей от 2 лет и подростков с сахарным диабетом I типа (общее количество участников составило 500 пациентов). Безопасность и эффективность референтного препарата инсулин гларгин, 100 ЕД/мл, у взрослых с сахарным диабетом II типа была подтверждена в двух клинических исследованиях с участием в общей сложности 1088 пациентов. Сердечно-сосудистая безопасность референтного препарата была изучена в ходе исследования ORIGIN, общее число участников которого составило 12537 пациентов. ГЕРОФАРМ проводил исследования безопасности и эффективности препарата РинГлар® в сравнении с референтным препаратом, чтобы доказать сопоставимость профилей препаратов. Подробное описание таких исследований приведено ниже. Исследования РинГлар® Многоцентровое открытое рандомизированное исследование иммуногенности, эффективности и безопасности препарата РинГлар® выполнено с участием пациентов с сахарным диабетом I типа (NCT04022993). В исследование скринировали 194 пациента, из которых 180 были рандомизированы. Средний возраст участников составил 38,5 ±10.84 лет, средний ИМТ – 24,3 кг/м2. Мужчин и женщин было примерно поровну: 53 % – мужчины, 47 % – женщины. Средняя продолжительность заболевания на момент включения в исследование составила 14 лет. Все пациенты до включения в данное исследование получали препараты инсулина в режиме базис-болюсной терапии. Исходный уровень HbA1c составил 8,65 %. Длительность применения препарата РинГлар® составила 26 недель, из которых 4 недели пришлись на период титрации. В среднем в группе препарата РинГлар® уровень гликированного гемоглобина уменьшился на 0,66 %. Количество пациентов, достигших уровня HbA1c≤ 7 %, составило 22 %. 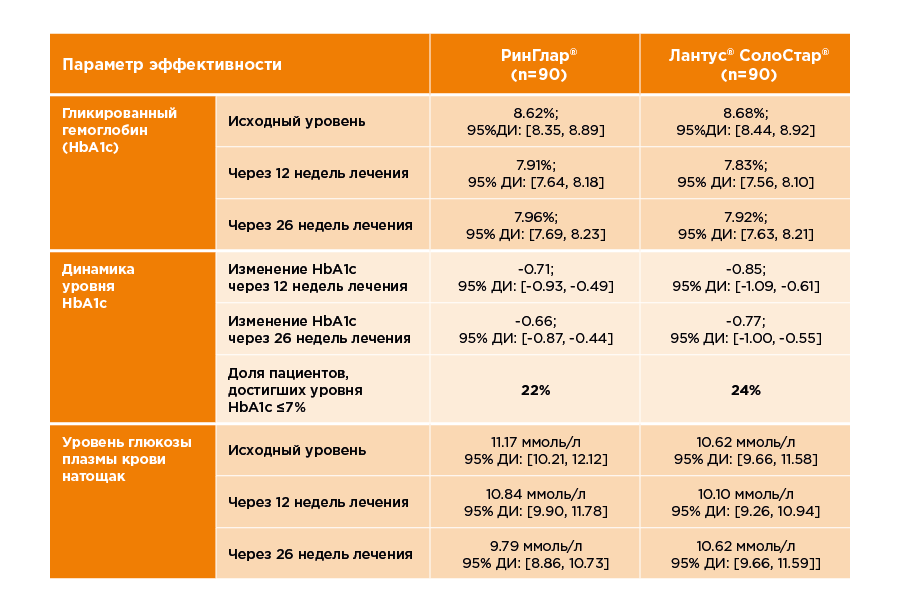 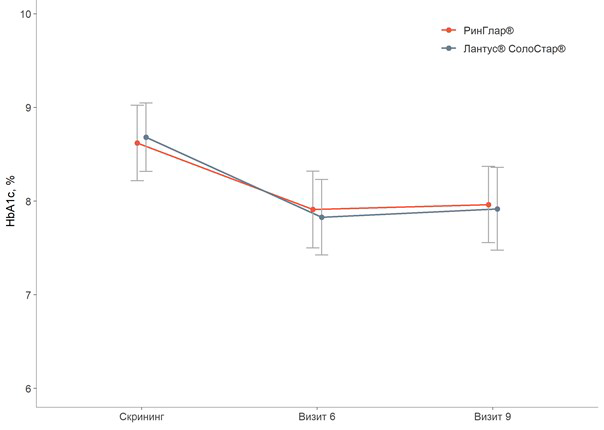
Рисунок 1 Изменение уровня гликированного гемоглобина (HbA1c) в плазме крови натощак через 12 недель лечения (Визит 6) и 26 недель лечения (Визит 9) по сравнению с исходным значением.
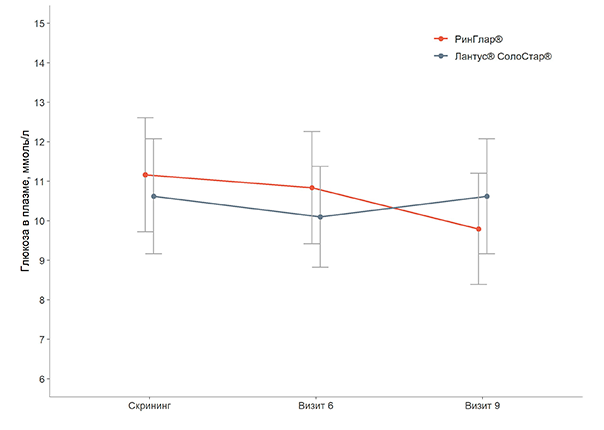
Рисунок 2 Изменение уровня глюкозы в плазме натощак через 12 недель лечения (Визит 6) и 26 недель лечения (Визит 9) по сравнению с исходным значением.По результатам исследования препарат РинГлар® и референтный препарат инсулин гларгин, 100 ЕД/мл сопоставимы по параметрам эффективности.
Эффективность инсулина гларгин у взрослых пациентов с сахарным диабетом I типа (данные исследований референтного препарата Лантус® Солостар®® в сравнении с генно-инженерным НПХ-инсулином человека, результаты актуальны для препарата РинГлар® на основании научного принципа экстраполяции* (перенос данных). В двух крупных рандомизированных контролируемых клинических исследованиях (Исследование А и Б) пациенты с сахарным диабетом I типа (Исследование А: n = 585; исследование Б: n = 534) были рандомизированы в группу референтного препарата инсулин гларгин, 100 ЕД/мл, один раз в сутки вечером или генно-инженерный НПХ-инсулин человека один или два раза в сутки в базис-болюсном режиме в течение 28 недель. Растворимый генно-инженерный инсулин человека вводили перед приемами пищи. В крупном рандомизированном клиническом исследовании (Исследование В: n = 619) пациенты с сахарным диабетом I типа получали референтный инсулин гларгин, 100 ЕД/мл, или генно-инженерный НПХ-инсулин человека в течение 16 недель в базис-болюсном режиме с препаратом инсулин лизпро. Инсулин гларгин пациенты вводили один раз в сутки в вечернее время, НПХ-инсулин пациенты вводили один или два раза в сутки, инсулин лизпро пациенты получали перед приемами пищи. В результате данных исследований было показано, что инсулин гларгин обладает сопоставимой с НПХ-инсулином человека эффективностью в отношении уровня гликированного гемоглобина, также препараты были сопоставимы по числу гипогликемий. Эффективность инсулин гларгин у детей и подростков с сахарным диабетом I типа (данные исследований референтного препарата Лантус® Солостар® в сравнении с генно-инженерным НПХ-инсулином человека, результаты актуальны для препарата РинГлар® на основании научного принципа экстраполяции* (перенос данных) В рандомизированном клиническом исследовании длительностью 28 недель пациенты в возрасте 6-15 лет с сахарным диабетом I типа (Исследование Г: n = 349) получали референтный препарат инсулин гларгин, 100 ЕД/мл один раз в сутки в вечернее время или генно-инженерный НПХ-инсулин человека один или два раза в сутки в базис-болюсном режиме. В качестве болюсного инсулина пациентам вводили растворимый инсулин человека перед едой. В результате исследования было показано, что инсулин гларгин и НПХ-инсулин человека обладают сопоставимым эффектом на уровень гликированного гемоглобина и частоту гипогликемий. В перекрестном сравнительном клиническом исследовании подростки в возрасте 12-18 лет (Исследование Д: n = 26) получали референтный инсулин гларгин, 100 ЕД/мл, в комбинации с препаратом инсулин лизпро и НПХ-инсулин человека в комбинации с растворимым инсулином человека в течение 16 недель каждый. По результатам исследования уровень глюкозы плазмы крови натощак был значимо ниже в группе препарата инсулина гларгин. Эффективность препаратов в отношении уровня гликированного гемоглобина была сопоставима между группами. Частота ночных гипогликемий была в группе препаратов инсулин гларгин/инсулин лизпро составила 32 %, в группе препаратов НПХ-инсулин/растворимый инсулин человека – 52 %. В клиническом исследовании длительностью 24 недели пациенты в возрасте 2-6 лет с сахарным диабетом I типа (Исследование Е: n = 125) получали референтный инсулин гларгин, 100 ЕД/мл, один раз в день в утренние часы или НПХ-инсулин человека один или два раза в день. Препараты болюсного инсулина обе группы получали перед едой. Не худшая эффективность в отношении уровня гликированного гемоглобина в группе препарата инсулин гларгин не достигнута. Эффективность инсулина гларгин у взрослых пациентов с сахарным диабетом II типа (данные исследований референтного препарата Лантус® Солостар® в сравнении с генно-инженерным НПХ-инсулином человека, результаты актуальны для препарата РинГлар® на основании научного принципа экстраполяции* (перенос данных) В крупном рандомизированном клиническом исследовании пациенты с сахарным диабетом II типа (Исследование Ж: n = 570) в течение 52 недель получали референтный препарат инсулин гларгин, 100 ЕД/мл, как часть комбинированной терапии с пероральными сахароснижающими препаратами (препараты сульфонилмочевины, метформин, акарабоза или их комбинация). Инсулин гларгин один раз в сутки в вечернее время оказывал сопоставимый эффект на уровень гликированного гемоглобина, что и НПХ-инсулин один раз в сутки в вечернее время. В другом клиническом исследовании пациенты с сахарным диабетом II типа (Исследование З: n = 518) получали референтный препарат инсулин гларгин, 100 ЕД/мл, или НПХ-инсулин человека в базис-болюсном режиме без других сопутствующих сахароснижающих препаратов в течение 28 недель. Сердечно-сосудистая безопасность (данные исследований референтного препарата Лантус® Солостар®, результаты актуальны для препарата РинГлар® на основании научного принципа экстраполяции* (переноса данных). В многоцентровом рандомизированном исследовании ORIGIN пациенты с сахарным диабетом II типа с установленным сердечно-сосудистым заболеванием или риском сердечно-сосудистых заболеваний (Исследование И: n = 12537) получали референтный препарат инсулин гларгин, 100 ЕД/мл или стандартную терапию. Общая частота серьезных сердечно-сосудистых осложнений и общая летальность значимо не отличались между группами.
*Экстраполяция — это устоявшийся научный принцип, который применяется в фармацевтике и предполагает перенос результатов исследований на другие показания применения препарата или группы пациентов на основании проведенных исследований сопоставимости.
-
13. Условия хранения
Не следует замораживать препарат РинГлар®. Также не следует использовать замороженный ранее препарат РинГлар®. Препарат РинГлар® следует хранить в защищенном от света или нагревания месте. Не следует использовать препарат РинГлар® после окончания срока годности. Шприц-ручку препарата РинГлар® необходимо использовать в течение 28 дней. По истечении 28 дней использования шприц-ручки ее необходимо утилизировать даже в том случае, если в ней осталась часть препарата. 
-
14. Информация для консультации пациентов
Не следует передавать шприц-ручку для использования другим людьми. Следует сообщить пациенту, что совместное использование шприц-ручки с другими людьми, даже при смене иглы, может привести к передаче различных инфекционных заболеваний. Гипергликемия и гипогликемия Пациента следует уведомить о том, что гипогликемия является наиболее частой нежелательной реакцией при использовании инсулина. Следует сообщить пациенту, как проявляются симптомы гипогликемии. Следует объяснить пациенту, что при возникновении гипогликемии может снижаться способность к концентрации внимания и быстрота реакции, это может быть опасно при вождении автомобиля или работе со сложными механизмами. Также пациенту следует сообщить, что изменение режима инсулинотерапии может приводить к гипер- или гипогликемиям. Изменение режима инсулинотерапии следует выполнять под контролем лечащего врача. Ошибочное введение Следует рассказать пациенту о необходимости проверки названия препарата перед каждым его использованием. Введение РинГлар® следует вводить только в том случае, если раствор выглядит как вода (прозрачный, бесцветный раствор без видимых частиц). Следует проверять препарат перед каждым введением. Следует сообщить пациенту, что препарат РинГлар® нельзя разводить или смешивать с другими препаратами инсулина. Действия пациента в особых ситуациях Пациенты должны быть обучены методам самостоятельного мониторинга глюкозы, технике инъекций инсулина, способам купирования гипогликемий и гипергликемий. Пациенты должны знать о мерах, которые они должны предпринять в случае развития сопутствующий заболеваний или стресса, в случае пропуска инъекции или введения неадекватной дозы, в случае пропуска приема пищи или неадекватного приема пищи. -
15. Информация для пациентов

|















